
UNIVERSITA’ DEGLI STUDI DI PARMA.
FACOLTA’ DI ARCHITETTURA.
CORSO DI FISICA TECNICA I, A. A. 2001/2002.
STUDENTESSA : Elena La Lomia, MATRICOLA 139153.
L’ENTROPIA.
Perché è facile mettere in disordine e mettere in ordine invece costa fatica?
Dal punto di vista fisico la cosa può essere spiegata facendo riferimento ad un principio fondamentale della termodinamica: in un sistema chiuso l'entropia totale non può diminuire.
Ma cos'è questa entropia? La si può definire disordine, ma più correttamente essa è uniformità.
Secondo il principio enunciato, perciò, 70 mattoncini di costruzioni tenderanno a disporsi uniformemente in ogni angolo della tua stanza: uno sul pavimento, uno sotto il cuscino, uno nella tazza di caffellatte... persino uno nella scatola con su scritto Lego!
Ovviamente puoi mettere in ordine, concentrare cioè tutti i mattoncini nella loro scatola, ma solo a costo di fatica e sudore, cioè rendendo più uniforme la distribuzione di umidità e temperatura nei vari punti della stanza (non dimenticare che anche tu fai parte del sistema chiuso "stanza"), ossia introducendo altri tipi di disordine.
Oppure puoi aprire la stanza e far mettere in ordine da qualcun altro, riducendo l'entropia del sistema aperto "stanza" a spese dell'aumento dell'entropia del sistema aperto "qualcun altro".
Questo fa capire quanto il concetto di ordine sia relativo: mettere in ordine qualcosa significa mettere in gran disordine qualcos'altro (concetto che ha pure ripercussioni filosofiche).
Ciò che caratterizza un organismo vivente è proprio questo: ogni cosa tende a rendere più uniforme l'universo, l'organismo vivente può farlo rendendo meno uniforme l'angolino di universo che lo circonda a spese di un maggiore scompaginamento del resto del mondo.
Morale? L'ordinato complica la vita agli altri.
Dare una definizione unica e sintetica di entropia non è possibile, perché l'entropia può essere presentata sotto vari aspetti e si può giungere ad una sua definizione con approcci diversi (assiomatico, statistico-probabilistico, informatico, termodinamico, ecc...).
L'entropia non è una grandezza direttamente misurabile, la sua esistenza non è direttamente suggerita dall'esperienza quotidiana e non è in alcun modo percepibile dai nostri sensi.
Infatti, prendendo in mano un oggetto e guardandolo, potremo renderci conto di che forma è, di che colore è, se è pesante o leggero, se è caldo o freddo, ma non potremmo mai renderci conto che quell'oggetto possiede un'entropia né tantomeno attribuire un valore a tale grandezza.
Pertanto il concetto di entropia risulta molto poco intuitivo e di non facile comprensione.
Tuttavia l'entropia è una grandezza fisica fondamentale per capire i fenomeni che avvengono in natura, non solo in Fisica, ma in qualunque altro campo scientifico.
L'aspetto forse più importante dell'entropia è proprio quello per cui noi, studiando le variazioni di entropia di un certo sistema, possiamo "predirne il futuro", possiamo cioè capire quali sono gli stati verso cui il sistema può evolvere e quali sono invece gli stati che gli sono preclusi.
Il fenomeno dell’entropia è un concetto formulato nella seconda metà del XIX secolo dal fisico tedesco Rudolph Gottlieb (Clausius) che, tra i fondatori della termodinamica moderna, definì uno degli enunciati del secondo principio. In questa relazione cercheremo di capire quale sia il significato di questo fenomeno, iniziando con le dovute introduzioni.
Reversibilità e irreversibilità
La più importante classificazione delle trasformazioni termodinamiche è quella che distingue le trasformazioni cosiddette reversibili da quelle irreversibili.
Chiameremo reversibili le trasformazioni che avvengono in un tempo al limite infinito e in cui non sono presenti effetti dissipativi (quali ad esempio quelli causati da viscosità, anelasticità, attriti, resistenze elettriche).
Trasformazioni reversibili in natura non ne esistono, ma potremo con buona approssimazione considerare tali le trasformazioni in cui le coordinate termodinamiche del sistema cambiano molto lentamente nel tempo e in cui sono stati ridotti al massimo gli attriti.
Agendo opportunamente, un sistema che ha compiuto una trasformazione reversibile può sempre essere riportato al suo stato iniziale senza che nell'ambiente circostante rimanga alcuna traccia della trasformazione avvenuta.
Una trasformazione reversibile è dunque una trasformazione che si svolge in modo tale per cui, alla fine, sia il sistema che l'ambiente circostante possono essere riportati ciascuno nel proprio stato iniziale senza che nell'Universo resti alcuna traccia.
Ad esempio, se il sistema durante una trasformazione reversibile assorbe calore da un altro corpo, invertendo la trasformazione restituisce a quello stesso corpo la quantità di calore che prima gli aveva sottratto.
Chiameremo irreversibili le trasformazioni che avvengono in un tempo finito e/o nelle quali sono presenti effetti dissipativi.
Una trasformazione irreversibile non è caratterizzata tanto dal fatto che il sistema non possa essere ricondotto nello stato iniziale (cosa invece quasi sempre realizzabile), ma dal fatto che ciò non possa avvenire senza che nell'ambiente circostante ne rimanga traccia.
L'espansione libera di un gas è un tipico esempio di trasformazione irreversibile. Consideriamo un recipiente a pareti rigide e adiabatiche, diviso in due camere da un setto ed immaginiamo che in una camera sia contenuta una certa quantità di gas, mentre nell'altra inizialmente ci sia il vuoto. Se togliamo il setto di separazione, il gas si espanderà fino ad occupare tutto il volume del recipiente.
Durante l' espansione (che non è contrastata da nessuna forza esterna), il gas non compie lavoro sull'ambiente, mentre per riportare il gas nel suo stato iniziale, l'ambiente deve compiere un lavoro non nullo sul gas (spontaneamente il gas non tornerebbe mai ad occupare il volume di partenza !).
La trasformazione è quindi irreversibile e la 'traccia' che rimane nell'ambiente è l'energia che si è dovuta spendere per riportare il gas al suo stato iniziale.
Come è già stato detto, tutte le trasformazioni che avvengono in natura sono più o meno irreversibili.
Rendimento
La grandezza che caratterizza il funzionamento delle macchine termiche è il rendimento definito come il rapporto fra il lavoro prodotto dalla macchina e la quantità di calore assorbita. Ricordando l'espressione data per il lavoro, avremo dunque:


Poichè l'enunciato di Kelvin del II Principio della Termodinamica nega la possibilità che una macchina termica possa produrre lavoro interagendo con una sola sorgente, la macchina più semplice che possiamo ipotizzare è una macchina che scambia calore con due soli serbatoi: uno caldo, da cui la macchina riceve calore, ed un altro freddo, a cui la macchina cede quella parte di calore che non è stata convertita in lavoro.
Per una tale macchina, chiamando Q  la quantità di calore assorbita e Q
la quantità di calore assorbita e Q  la quantità di calore ceduta, il rendimento può essere espresso come:
la quantità di calore ceduta, il rendimento può essere espresso come:
![]()
Macchina di Carnot
Tra tutte le macchine che scambiano calore con due soli serbatoi, chiamiamo Macchina di Carnot una macchina che compie un ciclo reversibile (detto Ciclo di Carnot) costituito in successione da una espansione isoterma, una espansione adiabatica, una compressione isoterma ed una compressione adiabatica.
Caratteristica peculiare di una tale macchina è che il suo rendimento non dipende dalla sostanza termodinamica che compie il ciclo, ma solo dalle temperature dei due serbatoi.
Chiamando T  la temperatura assoluta del serbatoio caldo e T
la temperatura assoluta del serbatoio caldo e T  la temperatura assoluta del serbatoio freddo, si può dimostrare che il rendimento risulta uguale a:
la temperatura assoluta del serbatoio freddo, si può dimostrare che il rendimento risulta uguale a:
![]()
Teorema di Carnot
Nessuna macchina che lavori tra due serbatoi può avere un rendimento superiore a quello di una macchina di Carnot che lavori tra i medesimi serbatoi.
Questo risultato, a cui pervenne Carnot intorno al 1825, è noto come teorema di Carnot. Per questo teorema sarà sempre:
![]()

![]()

![]()

Disuguaglianza di Clausius
Circa trenta anni più tardi Clausius generalizzò il precedente risultato al caso di una macchina termica interagente con un numero n di serbatoi (con n grande a piacere), dimostrando che:
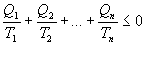


Estendendo poi tale risultato al caso in cui il sistema scambia calore con una distribuzione continua di sorgenti (ipotizzando cioè che il numero n delle sorgenti tenda all'infinito), scriveremo:
![]() (disuguaglianza di Clausius)
(disuguaglianza di Clausius)

 Q è la quantità infinitesima di calore scambiata dal sistema e T la temperatura della sorgente con cui è avvenuto lo scambio.
Q è la quantità infinitesima di calore scambiata dal sistema e T la temperatura della sorgente con cui è avvenuto lo scambio.
Ricordiamo che il simbolo usato per indicare la quantità infinitesima di calore scambiato, sottolinea il fatto che ![]() non rappresenta una 'variazione' di calore: infatti il calore non è una forma di energia che un sistema possiede (e che può quindi variare) ma è una energia di 'scambio'. Il calore viene definito proprio come l'energia che due sistemi si scambiano quando sono posti in contatto termico, in virtù di una loro differenza di temperatura.
non rappresenta una 'variazione' di calore: infatti il calore non è una forma di energia che un sistema possiede (e che può quindi variare) ma è una energia di 'scambio'. Il calore viene definito proprio come l'energia che due sistemi si scambiano quando sono posti in contatto termico, in virtù di una loro differenza di temperatura.
Il segno di uguaglianza, come è già stato ricordato, vale per cicli reversibili e il segno di minoranza per cicli irreversibili.
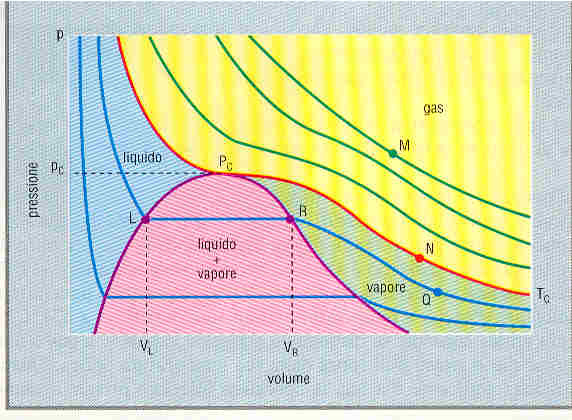
Viene riportato inoltre qui di seguito il diagramma di fase per una sostanza che si comporta come l’acqua. I punti che si trovano nella zona gialla descrivono un gas, quelli della zona verde un vapore, quelli della zona azzurra un liquido e quelli della zona rosa un vapore in equilibrio col suo liquido. L’isoterma critica (linea rossa) separa la zona relativa al gas dalle altre, mentre al di sopra il sistema è un gas per qualunque valore di p e di V. La linea viola è il luogo dei punti in cui inizia o finisce il processo di transizione vapore-liquido.
Per comprendere meglio il significato dell’entropia riporto qui di seguito un semplice esempio che tratta della variazione di entropia nella fusione del ghiaccio.
Un blocco di ghiaccio di massa m= 450g che si trova alla temperatura t= 0°C è posto a contatto di una sorgente di calore sino a completa fusione. Qual è la variazione di entropia del ghiaccio in tale trasformazione ?
Per fondere completamente, il ghiaccio deve assorbire una quantità di calore (positiva)
![]()
dove ![]() è il calore latente di fusione.
è il calore latente di fusione.
Dalla tabella che indica il valore ![]() di alcune sostanze, so che questo valore per l’acqua corrisponde a
di alcune sostanze, so che questo valore per l’acqua corrisponde a
![]()
Ottengo quindi
![]()
Sappiamo che durante la fusione del ghiaccio la temperatura rimane costante ; tale valore, a pressione normale, è
T= 0°C= 273 K.
Facendo riferimento alla formula
![]()
ottengo
![]()
che indica l’aumento di entropia del ghiaccio.
Per spiegare l’entropia in termini di trasformazioni fisiche prendo in considerazione due tipi di trasformazioni: quella isoterma e quella adiabatica, poste internamente reversibili.
Ricordando che ![]() e che
e che ![]() dove per
dove per ![]() intendo la variazione di entropia specifica e per q il calore specifico, la trasformazione isoterma dipende da pressione (asse y) e volume (asse x); per un gas ideale il grafico è quello di un’iperbole equilatera che ha per asintoti gli assi coordinati x e y: a temperatura costante se il volume aumenta, la pressione diminuisce e viceversa. La formula
intendo la variazione di entropia specifica e per q il calore specifico, la trasformazione isoterma dipende da pressione (asse y) e volume (asse x); per un gas ideale il grafico è quello di un’iperbole equilatera che ha per asintoti gli assi coordinati x e y: a temperatura costante se il volume aumenta, la pressione diminuisce e viceversa. La formula ![]() ci fa quindi capire che la variazione di entropia è direttamente proporzionale al calore che adopero per far passare la curva dal primo stato al secondo stato, essendo la temperatura costante.
ci fa quindi capire che la variazione di entropia è direttamente proporzionale al calore che adopero per far passare la curva dal primo stato al secondo stato, essendo la temperatura costante.
Infatti se prendo in esame un grafico (che ha la temperatura sull’asse y e la variazione specifica di entropia su quello delle x ) rappresentante una retta parallela all’asse x tra un punto 1 e un punto 2 (equivalenti a due stati differenti), mi accorgo che a temperatura costante l’entropia specifica aumenta, ossia ![]() ;
; ![]() .
.
La trasformazione adiabatica si ha invece quando il sistema non scambia calore con l’esterno (Q=0). Il grafico rappresenta ancora una volta un’iperbole ma, diminuendo la temperatura, si hanno linee che "scendono " in modo più ripido rispetto a quelle che rappresentano le trasformazioni isoterme.
La variazione specifica di entropia si nota osservando il seguente grafico
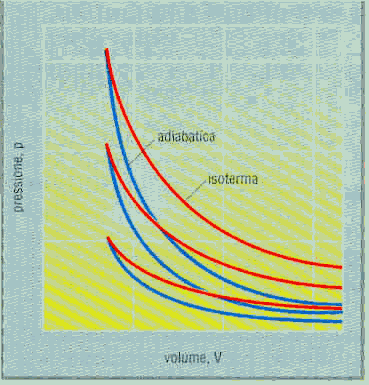
In cui la temperatura diminuisce ma l’area sottesa al grafico tra il punto 1 e il punto 2 rimane costante: ciò vuol dire che la variazione specifica di entropia rimane invariata.
A questo risultato, però, si può arrivare banalmente anche per via algebrica: se la trasformazione adiabatica per definizione pone Q=0, allora l’equazione ![]() diventa
diventa ![]() , ossia
, ossia ![]() .
.
In Fisica per solito si enunciano Principi di conservazione (ad esempio, il Principio di conservazione dell'energia) per sottolineare l'importanza del fatto che una certa grandezza si mantiene costante.
Da questo punto di vista l'entropia è una grandezza 'anomala' , in quanto per essa non vale un principio di conservazione, ma un 'principio di creazione'.
L'aumento di entropia che si registra in un sistema isolato, quando esso compie una trasformazione spontanea, è un accrescimento vero e proprio e non un trasferimento di entropia da una parte all'altra del sistema. Proprio a questo fatto l'entropia deve il suo nome : infatti Clausius la chiamò così per significare il 'contenuto in mutamento' (Verwandlunghinalt) che resta in ogni sistema dopo che ha compiuto una trasformazione irreversibile.
Si può utilizzare l'entropia anche per ridefinire la reversibilità e l'irreversibilità delle trasformazioni.
Chiameremo reversibili i processi durante i quali l'entropia di un sistema isolato resta costante (per questo motivo le trasformazioni adiabatiche reversibili sono anche chiamate isoentropiche) e irreversibili i processi in cui l'entropia di un tale sistema aumenta.
Più alto è il grado di irreversibilità della trasformazione, maggiore è la variazione totale di entropia, e viceversa.
L'entropia è stata definita come funzione di stato e in quanto tale può essere scelta come coordinata termodinamica per descrivere, insieme ad altre variabili, lo stato termodinamico di equilibrio di un certo sistema.
Abbiamo visto che un sistema semplice può essere descritto da due sole coordinate : queste coordinate possono essere temperatura ed entropia. Se ad esempio vogliamo rappresentare un ciclo di Carnot in termini di tali variabili, la descrizione sarà molto semplice e il ciclo in un diagramma T-S sarà rappresentato sempre da un rettangolo, indipendentemente dalla sostanza termodinamica utilizzata.
Tutti i fenomeni che avvengono spontaneamente sono irreversibili, con irreversibilità che possono essere di vario tipo.
Abbiamo ad esempio irreversibilità di tipo meccanico (come quando un corpo in movimento si arresta per attrito), di tipo termico (come quando il calore fluisce spontaneamente da un corpo caldo ad uno freddo), di tipo chimico (come quando viene bruciata una certa quantità di combustibile), di tipo biologico (come quando una cellula si moltiplica o quando un organismo vivente muore).
Ognuno di questi fenomeni potrebbe essere scelto per dare una formulazione del II Principio della Termodinamica del tutto equivalente a quella data da Kelvin nel suo enunciato.
Infatti si potrebbe dimostrare che, se fosse possibile invertire la direzione del processo naturale e spontaneo considerato, si arriverebbe a contraddire anche l'enunciato di Kelvin. Ad esempio, se il calore fluisse spontaneamente dai corpi più freddi verso i corpi più caldi (contrariamente a quanto affermato da Clausius nel suo enunciato del II Principio), questo fenomeno potrebbe essere sfruttato per costruire una macchina in grado di trasformare completamente in lavoro tutto il calore assorbito da una sola sorgente (in contraddizione a quanto enunciato da Kelvin).
Dunque si potrebbero dare tanti enunciati del II principio, quanti sono i processi irreversibili che si verificano spontaneamente, ma tutti sarebbero equivalenti all'enunciato di Kelvin e dunque tutti porterebbero al principio di aumento di entropia dell'Universo.
L'enunciato di Kelvin è il più conosciuto, perché è quello che porta più rapidamente e più facilmente alla definizione di entropia.
Dal principio di aumento di entropia dell'Universo possiamo ricavare anche la nozione dello scorrere del tempo.
L'evoluzione dell'Universo è una conseguenza diretta dell' irreversibilità intrinseca dei processi naturali, cioè di tutti i processi che avvengono spontaneamente.
Un fiammifero che brucia, un gas che si espande liberamente, un liquido colorato che si diffonde in acqua, sono fenomeni che ci fanno capire come l'evoluzione di un sistema avvenga di solito in un verso ben preciso: se filmassimo questi eventi e proiettassimo il film alla rovescia, ci accorgeremmo subito del trucco !
Il fatto che un sistema isolato possa evolvere spontaneamente solo verso stati ad entropia maggiore, implica l'esistenza di una sequenza temporale degli eventi, che dà significato alle parole passato e futuro, permettendoci di distinguere ciò che segue da ciò che precede.
Dunque mettere in ordine di entropia crescente i vari stati di un sistema che ha compiuto una trasformazione irreversibile equivale a metterli in ordine temporale !
Un sistema complesso, formato cioè da molti costituenti, lasciato a se stesso tende ad evolvere dall'ordine verso il disordine e poiché spontaneamente non avviene (praticamente mai) il contrario, possiamo definire il passaggio dall'ordine al disordine come un processo irreversibile. (In questo contesto daremo alle parole 'ordine' e 'disordine' il significato che hanno nella loro più comune accezione. In realtà, quando un sistema può esistere in più stati, si chiama per convezione 'ordine' uno di questi e 'disordine' l'insieme dei rimanenti. Così convenzionalmente si dice che un mazzo di carte è ordinato se le carte si presentano secondo una ben precisa sequenza di colore e valore).
Consideriamo un certo numero di biglie, in parte rosse e in parte blu, separate inizialmente per colore all'interno di un medesimo contenitore. Passato un certo periodo di tempo (lungo a piacere), se ci accorgiamo che le biglie, rompendo l'ordine iniziale, si sono mescolate fra loro, non ci stupiamo più di tanto, mentre ci stupiremmo molto del contrario, cioè se vedessimo le biglie, inizialmente mescolate all'interno del recipiente, separarsi spontaneamente per colore.
Immaginiamo ora di essere su una spiaggia deserta e di costruire un castello di sabbia. Se dopo qualche tempo troviamo il castello distrutto, non ci meravigliamo affatto. Ci meraviglieremmo molto invece se vedessimo un mucchio informe di sabbia trasformarsi spontaneamente in un castello.
Questi esempi ci fanno capire che il disordine è lo stato verso cui ogni sistema evolve spontaneamente.
D'altro canto abbiamo visto che i sistemi isolati evolvono sempre verso stati di maggiore entropia, per cui potremmo enunciare il II Principio anche affermando che ogni sistema isolato evolve verso stati di disordine via via crescente.
Tuttavia, in apparente contraddizione con quanto enunciato ora, l'esperienza quotidiana ci offre esempi di sistemi che evolvono verso stati di ordine maggiore : quando la temperatura è sufficientemente bassa, la pioggia si tramuta in neve e le molecole d'acqua contenute nelle gocce di pioggia si dispongono in modo ordinato, formando cristalli di ghiaccio. Anche la struttura con cui si organizzano le molecole in un essere vivente per farlo nascere e per mantenerlo in vita è una struttura fortemente ordinata.
Nei sistemi complessi si generano continuamente strutture, organizzazioni, cioè si crea ordine.
Come è possibile tutto ciò ?
Non solo negli esempi citati, ma ogni volta che un sistema evolve verso stati di ordine maggiore, significa che il sistema non è isolato.
Il maggior ordine raggiunto dal sistema è a scapito di un maggior disordine che il sistema riversa nell'ambiente, ovvero la diminuzione di entropia del sistema è più che compensata dall'aumento di entropia di ciò che ha interagito con il sistema stesso.
Esula dal nostro tema capire perchè questi elevati gradi di ordine (necessari ad ogni forma di vita), si realizzino, tuttavia è importante sapere che questo avviene senza che siano violati i principi della Fisica.
Dunque: localmente l'entropia di un sistema può anche diminuire, ma complessivamente nell'Universo può solo aumentare!
Nel linguaggio corrente spesso vengono utilizzate frasi del tipo:
L'umanità 'consuma' energia, oppure:
Le risorse energetiche sulla Terra vanno 'esaurendosi' e simili.
Eppure noi sappiamo che l'energia di un sistema isolato (per il I Principio della Termodinamica) si conserva sempre. Come abbiamo già ricordato l'energia si trasforma da una forma ad un'altra, si trasferisce da un corpo ad un altro, può essere accumulata o liberata, ma si mantiene costante.
Quando si parla impropriamente di 'consumo di energia', di 'diminuzione di energia', in realtà si intende parlare di un altro fenomeno che accompagna tutti i fenomeni irreversibili: la 'degradazione' dell'energia.
Immaginiamo ad esempio di bruciare una certa quantità di combustibile e di raccogliere tutti i prodotti della combustione (calore, fumo, ceneri, ecc...) : in base al I Principio possiamo affermare che essi contengono esattamente la stessa quantità di energia che era contenuta nel combustibile di partenza.
Eppure è indubbio che se la quantità di energia è la stessa, la qualità è cambiata.
Tenendo presente che l'energia è tanto più preziosa quanto maggiore è il lavoro che se ne può ricavare, risulta chiaro che non tutte le forme di energia sono fra loro equivalenti: ci sono energie di tipo nobile, più versatili (quali l'energia cinetica, l'energia potenziale, l'energia elettrica e quella chimica), che possono essere tramutate in lavoro quasi integralmente e altre forme meno pregiate, che possono essere trasformate solo con ben precise limitazioni.
Il tipo di energia meno nobile, in quanto può essere trasformata o trasferita solo con i limiti imposti dal II principio della Termodinamica, è il calore. Ed il calore è tanto meno pregiato, quanto più bassa è la temperatura della sorgente da cui può essere estratto.
Alla fine di ogni processo naturale c'è sempre una certa quantità di energia pregiata che viene trasformata in una forma meno pregiata e meno utile per compiere del lavoro.
Chiamiamo energia degradata la quantità di energia che alla fine di ogni trasformazione irreversibile non può più essere utilizzata per compiere del lavoro. L'energia divenuta inutilizzabile è proporzionale alla variazione totale di entropia prodottasi a causa dell'irreversibilità del processo (in particolare, si potrebbe dimostrare che è uguale al prodotto fra la variazione di entropia dell'Universo causata dal processo irreversibile e la temperatura assoluta del serbatoio più freddo intervenuto nel processo stesso).
Quanto detto finora in molte situazioni non è facilmente applicabile : infatti l'entropia è stata introdotta come funzione di stato (dove per stato si intende uno stato di equilibrio), mentre i sistemi aperti (quali, ad esempio, tutti gli organismi viventi) sono in genere molto lontani dall'equilibrio termodinamico. La termodinamica classica (o termodinamica degli stati di equilibrio) risulta quindi inadeguata alla descrizione di tali sistemi.
Per descrivere sistemi di questo tipo e le trasformazioni che essi compiono è necessario ricorrere alla Termodinamica dei sistemi non in equilibrio e alla Sinergetica, la quale (oltre ad occuparsi di sistemi complessi lontani dall'equlibrio) tratta anche di fenomeni che esulano dal campo delle scienze naturali, quali l'economia e la sociologia.
Tuttavia si può dimostrare che anche questi sistemi ubbidiscono al Principio di aumento di entropia dell'Universo.
Il II Principio, inteso come principio di aumento dell'entropia, è legato alla irreversibilità intrinseca di tutti i fenomeni naturali.
Noi lo abbiamo ricavato osservando il funzionamento delle macchine termiche, ma la sua validità è del tutto generale, pertanto applicabile alla evoluzione spontanea (e quindi irreversibile) di un qualunque sistema.
A causa della sua validità universale, il II Principio pone dei limiti a quello che può accadere in qualunque processo.
A questo proposito è utile sottolineare come fra il I e il II Principio della Termodinamica, quello che governa il mondo, quello che stabilisce come devono andare le cose, quello che 'comanda' insomma, non è il Principio di conservazione dell'energia, ma il Principio di aumento dell'entropia. Infatti il II Principio determina quali sono i processi che possono accadere, mentre il I Principio si 'limita' ad affermare che, all'interno di quei processi, il bilancio energetico deve andare in pareggio.