CORSO DI FISICA TECNICA A
ANNO 2001/2002
Prof. ANGELO FARINA
FACOLTA’ DI ARCHITETTURA – UNIVERSITA’ DEGLI STUDI DI PARMA
ESERCIZI SU MISCELE D’ARIA E VAPOR D’ACQUA
Primo principio della termodinamica
Sia dato un sistema chiuso che scambia con l’esterno, nell’intervallo di tempo dt, il lavoro elementare dL e il calore elementare dQ. La relazione che esprime il primo principio è precisata con l’introduzione di altri due termini energetici che caratterizzano il sistema nella sua costituzione e condizioni istantanee: il primo, definito in relazione ad un riferimento spazio-temporale, viene scisso in variazione dell’energia cinetica dEc e variazione dell’energia potenziale dEp. Il secondo, che può essere definito indipendentemente da ogni riferimento esterno, è detto variazione dell’energia interna dU. La relazione si scrive dQ=dEc+dEp+dU+dL. Se il sistema chiuso è fermo rispetto al riferimento inerziale, risulta dEc=0, e se inoltre la dEp è dovuta tutta al campo gravitazionale, è anche dEp=0; pertanto la precedente diventa dQ=dU+dL. La U è una funzione delle variabili necessarie per definire il sistema, è cioè funzione dello stato del sistema. Riassumendo la variazione di energia interna di un sistema è pari alla somma del lavoro svolto (positivo se fatto dal sistema, negativo se subito) e del calore scambiato dal sistema (positivo se assorbito, negativo se ceduto).
Entalpia
L’entalpia è una funzione di stato di un sistema ed esprime la quantità di energia che esso può scambiare con l’ambiente. In una reazione chimica, ad esempio, l’entalpia scambiata dal sistema consiste nel calore assorbito o rilasciato nel corso della reazione. Nel caso di un passaggio di stato, ad esempio nel passaggio di una sostanza da liquida a gassosa, l’entalpia del sistema è il calore di evaporazione. Invece in un processo di variazione della temperatura l’entalpia è data dalla capacità termica a pressione costante. La definizione di entalpia è:
![]()
Una reazione con variazione d’entalpia negativa è esotermica, mentre una reazione con variazione d’entalpia positiva è endotermica.
Calore specifico e entalpia specifica di una miscela aria-vapore
Il calore specifico a pressione costante cp è la media pesata dei calori specifici dell’aria e del vapore per la miscela considerata. La sua definizione è:
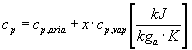
L’entalpia specifica di una miscela aria e vapore è
![]() ,
,
dove ha è l’entalpia specifica dell’aria secca, mentre hv è l’entalpia specifica del vapore d’acqua. Assumendo come stato convenzionale a valore nullo di entalpia il gas ideale a T0=273,15 K (0°C), risulta:
![]()
Si assume per l’acqua quale stato convenzionale a entalpia nulla lo stato di liquido saturo a T0=273,15 K. L’entalpia specifica del vapore d’acqua, dipendendo solo dal valore della temperatura in quanto considerato gas ideale, può essere calcolata con questa relazione:
![]() ,
,
dove r0 è il valore del calore di vaporizzazione dell’acqua a T=273,15 K.
Calore specifico dell’aria: cp,a=1 kJ/kgaK.
Calore specifico del vapore d’acqua: cp,v=1,9 kJ/kgvK.
Calore specifico dell’acqua: cp,ac=4,81 kJ/kgvK.
Calore di vaporizzazione dell’acqua: r0=2500 kJ/kgv.
Entalpia specifica dell’aria umida: h=t+x(2500+1,9t) kJ/kga.
Umidità
L’aria è definita in diversi modi a seconda della sua composizione. Questi sono:
- aria atmosferica, contenente principalmente azoto e ossigeno, ed una miscela di altri gas, tra cui anidride carbonica, vapore acqueo e varie sostanze inquinanti. È l’aria che respiriamo, che è utilizzata negli impianti di condizionamento.
- aria secca, costituita da azoto (circa 78%), ossigeno (circa 21%) e da piccole quantità di gas, come argon, neon, anidride carbonica.
- aria umida, che è una miscela di aria secca e vapore acqueo.
Per definire le grandezze relative all’aria umida occorre considerare che, mentre i gas (N2, O2, Ar, ecc.) che costituiscono l’aria si trovano molto sopra la propria isoterma critica, quindi rimangono allo stato gassoso, invece il vapore d’acqua si trova al di sotto della propria isoterma critica e può diventare liquido (rugiada, nebbia) o addirittura solido (brina). Per l’aria umida valgono le leggi di Dalton: la pressione totale è la somma delle pressioni parziali
![]()
le pressioni dei componenti sono proporzionali alle quantità di essi espresse come numero di molecole:
![]()
Se a un dato volume d’aria si aggiunge altro vapore acqueo, la pressione parziale di quest’ultimo aumenta. Quando questa pressione parziale raggiunge il valore della pressione di vapore a quella temperatura, si dice che l’aria è satura. A quel punto il vapore acqueo inizia a condensare in forma liquida se la temperatura è superiore al punto di fusione, o sotto forma di cristalli di ghiaccio (neve o brina) se la temperatura è inferiore al punto di fusione. Il rapporto tra la pressione parziale del vapore acqueo e la pressione di vapore a quella temperatura è chiamata umidità relativa. È da sottolineare che l’aria può essere satura solo se è in contatto con acqua liquida (sopra e vicino ad uno specchio d’acqua, quando piove), altrimenti contiene una quantità di acqua (allo stato di vapore) minore della saturazione. Se ne contiene una quantità maggiore, condensa e si separa (nebbia, rugiada).
Esperimento del bicchiere d’acqua
Si tratta di un esperimento che consente di capire meglio i concetti di aria secca e aria umida. Consiste nella disposizione di un bicchiere pieno d’acqua sotto ad una campana al cui interno è presente aria secca a temperatura T costante e pressione p=1 bar. Si nota che, dopo un certo tempo, parte dell’acqua contenuta nel bicchiere è evaporata e il vapore che si è formato ha trasformato l’aria da secca in umida. Il processo continuerà fino a quando il titolo raggiungerà il punto di saturazione.

Esistono due diverse grandezze per indicare la quantità di vapore acqueo presente nell’aria:
- il titolo, definito come rapporto tra massa di vapore e massa di aria secca:
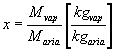
Non è da confondere con il titolo che caratterizza i vapori saturi, definito come
![]()
che è un numero compreso tra 0 e 1.
- il grado igrometrico o umidità relativa, grandezza definita come rapporto tra la pressione parziale del vapore acqueo e la pressione del vapore saturo a quella temperatura:
![]()
Questa grandezza è compresa tra 0 e 1 e può essere definita in forma percentuale, tramite una moltiplicazione per cento.
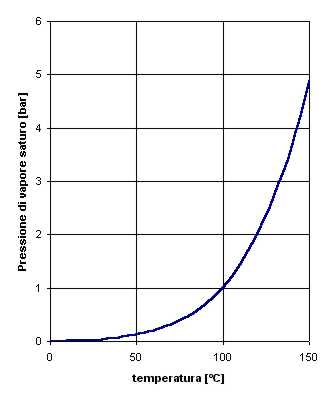
Il valore della pressione del vapore saturo dipende dalla temperatura e si ricava dalla seguente tabella:
Tabella 1:
|
Temperatura dell’aria t (°C) |
Pressione di vapore saturo ps (bar) |
Titolo di saturazione x (gvap/kgaria) |
|
-20 |
0,00102 |
0,63 |
|
-15 |
0,00163 |
1,01 |
|
-10 |
0,00256 |
1,60 |
|
-5 |
0,00396 |
2,49 |
|
0 |
0,00600 |
3,78 |
|
2 |
0,00705 |
4,37 |
|
4 |
0,00812 |
5,03 |
|
6 |
0,00934 |
5,79 |
|
8 |
0,01072 |
6,65 |
|
10 |
0,01277 |
7,63 |
|
12 |
0,01401 |
8,75 |
|
14 |
0,01596 |
9,97 |
|
16 |
0,01816 |
11,4 |
|
18 |
0,02062 |
12,9 |
|
20 |
0,02336 |
14,7 |
|
22 |
0,02642 |
16,6 |
|
24 |
0,02982 |
18,8 |
|
26 |
0,03360 |
21,4 |
|
28 |
0,03778 |
24,0 |
|
30 |
0,04241 |
27,2 |
|
32 |
0,04753 |
30,6 |
|
34 |
0,05318 |
34,4 |
|
36 |
0,05940 |
38,8 |
|
38 |
0,06609 |
43,5 |
|
40 |
0,07358 |
48,8 |
I valori della pressione del vapore saturo in funzione della temperatura possono essere rappresentati graficamente. Inoltre dall’equazione di Clausius-Clapeyron si ricava un’equazione che approssima i dati sperimentali della tabella:
![]()
Tra titolo e grado igrometrico esiste una relazione:
dal momento che ![]() , dalla definizione di grado
igrometrico
, dalla definizione di grado
igrometrico
e ![]() , dalla legge di Dalton,
, dalla legge di Dalton,
si ottiene che:
![]()
dove nv e na rappresentano rispettivamente il numero di moli di vapore e di aria secca presenti nella miscela di aria umida considerata, e mv e ma le masse molari dei due componenti. Con ptot si intende la pressione totale della massa d’aria umida presa in considerazione e ps la pressione di saturazione del vapore alla temperatura considerata.
Il valore di x tale per cui j=1 è detto titolo di saturazione.
La temperatura alla quale l’aria diventa satura di vapore acqueo, cioè quando l’umidità relativa è pari al 100%, è detta punto di rugiada. Quando la superficie della Terra di notte si raffredda al di sotto del punto di rugiada, si forma rugiada, se il punto di rugiada è maggiore di 0°C, o si forma brina, se esso è minore di 0°C.
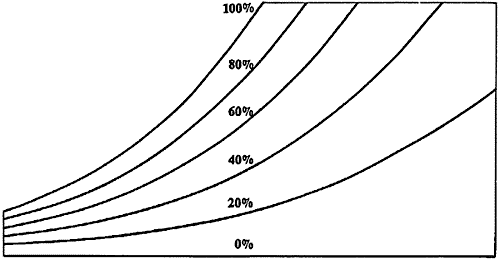
Diagramma psicrometrico
Il diagramma psicrometrico è una rappresentazione grafica delle proprietà dell’aria in varie situazioni. Assmann realizzò per primo il diagramma psicrometrico in relazione alla sua invenzione, lo psicrometro o igrometro. Si struttura in questo modo: sull’asse delle ascisse si trova la temperatura t, mentre sull’asse delle ordinate si trova il titolo x, misurato in gvap/kgaria.
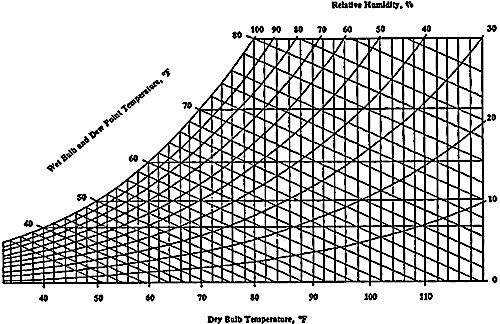
Nel diagramma sono utilizzati tre diversi tipi di misurazione della temperatura:
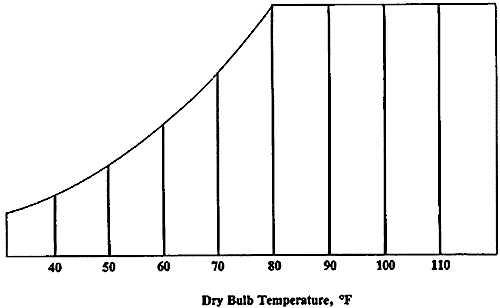
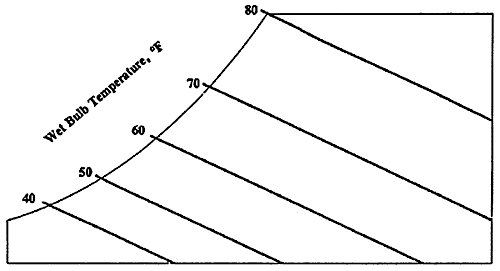
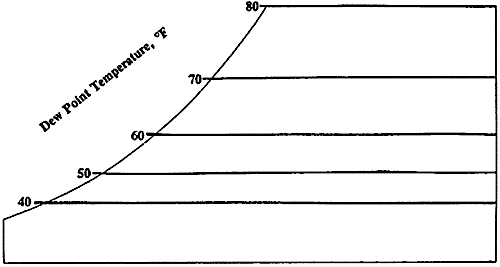
L’umidità relativa, in percentuale, è espressa nel diagramma psicrometrico da linee curve che partono in basso a sinistra ed arrivano in alto a destra. La linea relativa al 100% corrisponde alla scala delle temperature del bulbo umido e del punto di rugiada. Quella relativa allo 0% è invece sulla scala della temperatura del bulbo secco.
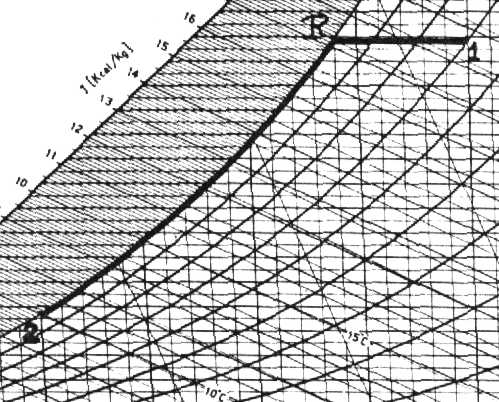
Esercizio 1 – Raffreddamento di aria umida
Una massa M=10 kg di aria umida avente grado igrometrico j=0,7, inizialmente alla temperatura di 30°C, viene raffreddata fino alla temperatura di 10°C seguendo la trasformazione indicata in figura. Si determinino la quantità di calore Q da sottrarre alla miscela e la massa d’acqua che condensa. Si supponga che la trasformazione avvenga ad una pressione costante p=1,013 bar.
Dati:
Massa totale: Mtot=10 kg
Temperatura iniziale: t1=30°C
Grado igrometrico iniziale: j=0,7
Temperatura finale: t2=10°C
Pressione: p=1,013 bar
Quesiti:
Quantità di calore da sottrarre: Q=?
Massa d’acqua condensata durante il processo: Mcond=?
Risoluzione:
Per capire come avverrà la trasformazione, è necessario osservare il diagramma psicrometrico relativo al problema. Da questo si rileva che la trasformazione avviene in due fasi: nella prima il sistema subisce un raffreddamento, mantenendo il titolo costante fino al raggiungimento della curva di saturazione j=1 (punto R). In questo punto la temperatura è tR=24°C e viene definita temperatura di rugiada, dal momento che, essendo la miscela già satura, se la si raffredda ulteriormente il vapore d’acqua presente condensa. Durante la seconda fase, il raffreddamento continua fino al raggiungimento di 10°C, quindi la trasformazione R-2 avviene lungo la curva di saturazione. Durante questa, lungo la curva di saturazione, si ha la presenza contemporanea di due fasi in equilibrio termodinamico: aria satura di vapore e acqua.
Dal momento che la trasformazione avviene a pressione costante, dal primo principio della termodinamica risulta dh=dq-dl; non si compie lavoro in quanto semplice raffreddamento, quindi Q=Ma(J2-J1).
È necessario determinare la massa d’aria secca Ma presente nella miscela, in quanto le entalpie sono riferite ad un kg di aria secca. Quindi:
![]() ed essendo
ed essendo ![]() si ha
si ha
![]() da cui
da cui ![]() .
.
Dalla tabella: ps=0,0424 bar=31,8 mm Hg è la pressione di saturazione del vapore a 30°C.
Nello stato iniziale il titolo della miscela vale:
![]()
Noto il titolo x1, si può ricavare la massa d’aria secca Ma presente nella miscela:
![]()
Ora si calcolino le entalpie della miscela negli stati iniziale e finale:
![]()
Essendo ![]()
Si ha:
![]()
Infine:
![]()
La quantità di calore scambiata durante la trasformazione è negativa dal momento che viene sottratta al sistema.
Esercizio 2 - Miscelatore
In un miscelatore entrano due correnti di miscela d’aria e vapore, una di M1=1500 kg/h, alla temperatura t1=5°C e l’altra M2=3000 kg/h alla temperatura t2=15°C. I rispettivi titoli sono x1=4,5 gV/kga e x2=6 gV/kga. All’uscita sono richieste queste condizioni termoigrometriche: temperatura t4=22°C e titolo x4=8 gV/kga. Al fine di ottenere queste condizioni, è necessario fornire una quantità m3 d’acqua alla temperatura t3=17°C ed una quantità Q di calore.

Si calcolino:
Dati:
M1=1500 kg /h t1=5°C x1=4,5 gV/kga
M2=3000 kg/h t2=15°C x2=6 gV/kga
t3=17°C
t4=22°C x4=8 gV/kga
Quesiti:
a) Portata d’aria in uscita: M4=?
b) Portata d’acqua necessaria: m3=?
c) Quantità di calore da fornire: Q=?
Risoluzione:
![]()
Per le miscele d’aria e vapore acqueo si prende in esame, in genere, la portata d’aria secca; quindi, essendo M la portata della miscela, si ha:
![]()
dove Ma è la portata d’aria secca e MV la portata di vapore. Dalla definizione di titolo:
![]()
si ottiene : ![]() da cui
da cui ![]() .
.
Il bilancio di massa per il vapore d’acqua è espresso da:
![]()
La portata d’aria secca M4 e quella d’acqua m3 si determinano dalle due relazioni di bilancio di massa. Si ha:
![]()
da cui
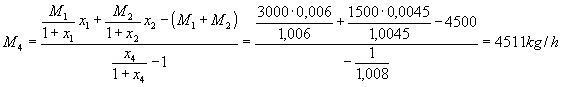
![]()
![]()
Sostituendo i valori numerici:
![]()
![]()
![]()
Dalle tabelle si ricava il valore dell’entalpia dell’acqua a 17°C:
![]()
Sostituendo i valori calcolati nell’equazione del bilancio energetico si ottiene Q:
![]()
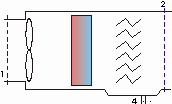
Esercizio 3 – Condizionatore d’aria
Un ambiente di 470 m3di volume è mantenuto ad una temperatura di 20°C e ad un’umidità relativa del 52,5%. Si consideri che l’aria nell’ambiente viene completamente ricambiata ogni ora e prelevata dall’atmosfera nelle seguenti condizioni: pressione p=1 bar, temperatura t=32°C, umidità relativa j=0,86. Questo avviene mediante un ventilatore che fornisce la potenza utile di 450 W. Come si vede in figura, l’aria passa attraverso una batteria di raffreddamento che ne abbassa la temperatura fino al raggiungimento della condensazione di una parte di vapore in essa presente; il condensato viene raccolto ad una temperatura di 8°C. l’aria satura è poi riscaldata fino a raggiungere le condizioni richieste. La pressione totale si mantiene costante.
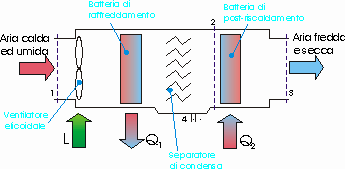
Determinare:
Dati:
Volume: V=470 m3
Pressione: p=1 bar
Temperatura dell’aria esterna: t1=32°C
Grado igrometrico dell’aria esterna: j=0,86
Temperatura dell’aria interna: t3=20°C
Potenza fornita dalla ventola: L=0,45 kW
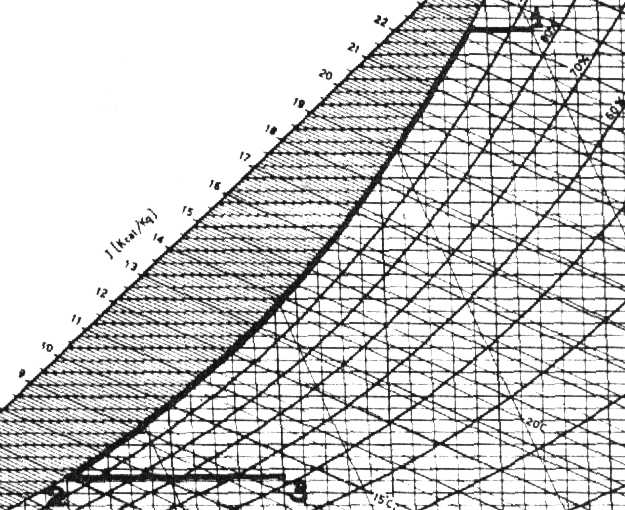
Quesiti:
Risoluzione:
![]() da cui
da cui ![]()
![]()
Dalla tabella 1 si ricava la temperatura t2 in funzione della pressione del vapore:
t2=10°C
![]()
Tenendo presente che nel punto 1 e nel punto 3 la temperatura vale rispettivamente 32°C e 20°C, si ricavano i titoli x1 e x3 dell’aria in ingresso e in uscita dal condizionatore:
![]()
![]()
Il bilancio di massa per il vapore d’acqua, riferito al kg di aria secca, risulta:
![]()
Dall’equazione dei gas perfetti
![]()
si ricava la portata di aria secca:
![]()
Per calcolare la portata di massa condensata in un’ora è sufficiente moltiplicare la massa d’aria per la differenza dei titoli:
![]()
![]()
dove hcond rappresenta l’entalpia specifica della massa condensata;
ora calcoliamo le entalpie J1 e J2:
![]()
![]()
L’entalpia specifica dell’acqua condensata è
![]()
dove c è il calore specifico per l’acqua ed è pari a 4,18 kJ/kgK, quindi
![]()
Sostituendo nell’equazione del bilancio energetico:
![]()
La quantità di calore Q risulta negativa in quanto sottratta al sistema. Nel sistema non si è tenuto conto dell’energia scambiata sotto forma di calore attraverso il ventilatore.
![]() e quindi:
e quindi:
![]()
Sostituendo nell’equazione del bilancio energetico, si ha:
![]()