Daniele Buttarelli, 139343
22/11/2001; ore lezione: 14:30-16:30
GAS NOBILI
Il gas è uno stato d’aggregazione della materia tale che le particelle costituenti (atomi, molecole e ioni) possiedono un’energia cinetica (in altre parole di movimento) che prevale sulle forze di reciproca attrazione. Esse, non hanno perciò ne forma né volumi propri, ma tendono ad occupare tutto lo spazio disponibile per esempio quelle di un recipiente chiuso, urtando continuamente tra loro e contro le pareti del recipiente che lo contengono (da questi urti è determinata la pressione esercitata dal gas). Per lo studio del comportamento dei gas, è utile far riferimento ad un modello di gas detti "gas perfetti", le cui molecole hanno un volume trascurabile e non risentono d’alcuna forza d’attrazione e gli urti tra le molecole e tra queste e le pareti del contenitore sono perfettamente elastici, è in altre parole conservata l’energia cinetica globale delle molecole.
Possiamo capire meglio questo se analizziamo l’atomo, il qual è la più piccola frazione di un elemento in grado di conservare le caratteristiche chimiche e fisiche. È una struttura complessa costituita da diversi tipi di particelle: protoni (che portano una carica positiva), neutroni (elettricamente neutri) ed elettroni (che portano una carica negativa. Protoni e neutroni sono riuniti nel nucleo attorno al quale sono distribuiti gli elettroni.
La massa del protone e del neutrone è 1,6 ×
10 ![]() Kg mentre la massa dell’elettrone è di 9,1 ×
10
Kg mentre la massa dell’elettrone è di 9,1 ×
10![]() Kg; uno è un millesimo dell’altra, la carica di una è identica all’altra. È difficile, per un atomo, perdere neutroni o protoni mentre è molto semplice perdere elettroni nei vari legami chimici.
Kg; uno è un millesimo dell’altra, la carica di una è identica all’altra. È difficile, per un atomo, perdere neutroni o protoni mentre è molto semplice perdere elettroni nei vari legami chimici.
Il diverso numero di protoni nel nucleo caratterizza i differenti elementi , tale numero è detto NUMERO ATOMICO (Z); il numero di neucloni (cioè la somma del numero di protoni e neutroni) è definito invece NUMERO DI MASSA (N) o MASSA ATOMICA o PESO ATOMICO .
La massa di un atomo è uguale al numero d’elettroni più il numero di protoni per la loro massa.
Le molecole possono essere monoatomiche e biatomiche: N![]() , O
, O![]() , H
, H![]() .
.
MOLECOLA DI METANO CH![]() , Gas combustibile che si trova in natura.
, Gas combustibile che si trova in natura.

22/11/2001; ore lezione: 14:30-16:30
REAZIONE CHIMICA
Combustione del metano
![]()
è una reazione esoterma, cioè rilascia energia.
![]()
è una reazione endotermica, cioè usa energia
PILA A COMBUSTIONE
Le pile a combustione si differenziano dalle comuni pile elettriche perché sono basate su una reazione di combustione controllata, in cui il combustibile è ossigeno O![]() e il prodotto finale è H
e il prodotto finale è H![]() O.
O.
Nella pila c’è un elettrolita cui saranno attaccate due barrette di ferro con cariche una positiva (catodo) ed una negativa (anodo), quindi faremo entrare da una parte l’ossigeno e dall’altra l’idrogeno e otterremo che da una parte uscirà ossigeno e dall’altra idrogeno più vapore d’acqua. Se alle barrette attacchiamo una lampadina questa si accenderà.
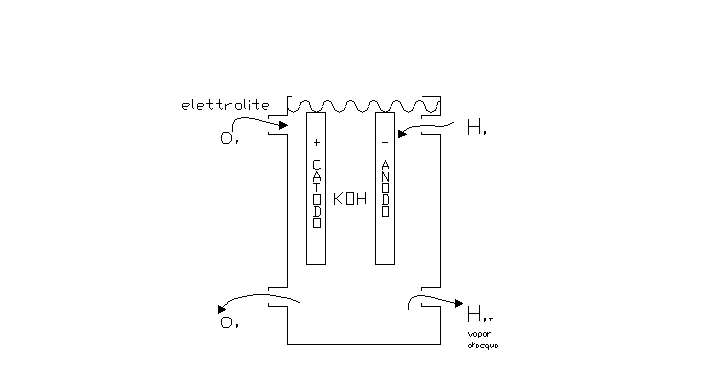
Reazione che avviene all’interno della pila (reazione di combustione)

se metto due lamelle in acqua e sale (NaCl) e queste le unisco ad una pila avrò la reazione inversa infatti vicino alle lamelle ottengo le molecole di H2 e O2 separate
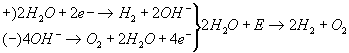
22/11/2001; ore lezione: 14:30-16:30
LA MOLE
La mole è l’unità di misura della quantità di sostanza nel sistema internazionale, espressa in grammi, che contiene un numero di unità elementari (atomi, ioni o molecole) uguale al numero d’atomi contenuti in 12 grammi di carbonio 12, per definizione, una mole di una qualunque sostanza contiene sempre lo stesso numero di particelle: tale numero e detto NUMERO D’AVOGADRO e il suo valore è fissato a 6,023× 1023.
Il peso atomico è il peso dell’atomo. (p.a.)
Il peso molecolare è il peso della molecola. (p.m.)
H2O p.a. H2=1
p.a.O2=16 (8e-;8e+)
p.m. H2O=16+2=18
1 mole = 6,023× 1023 molecole
se prendo 18g di acqua avrò una mole d’acqua e 6,023× 1023 molecole di H2O.
p.m. O2= 16+16= 32
32 g O2= 1 mole di O2 e 6,023× 1023 molecole di O2
il gas ideale è un gas in cui la situazione è talmente rarefatta che le molecole non vengono a scontrarsi l’una con l’altra.
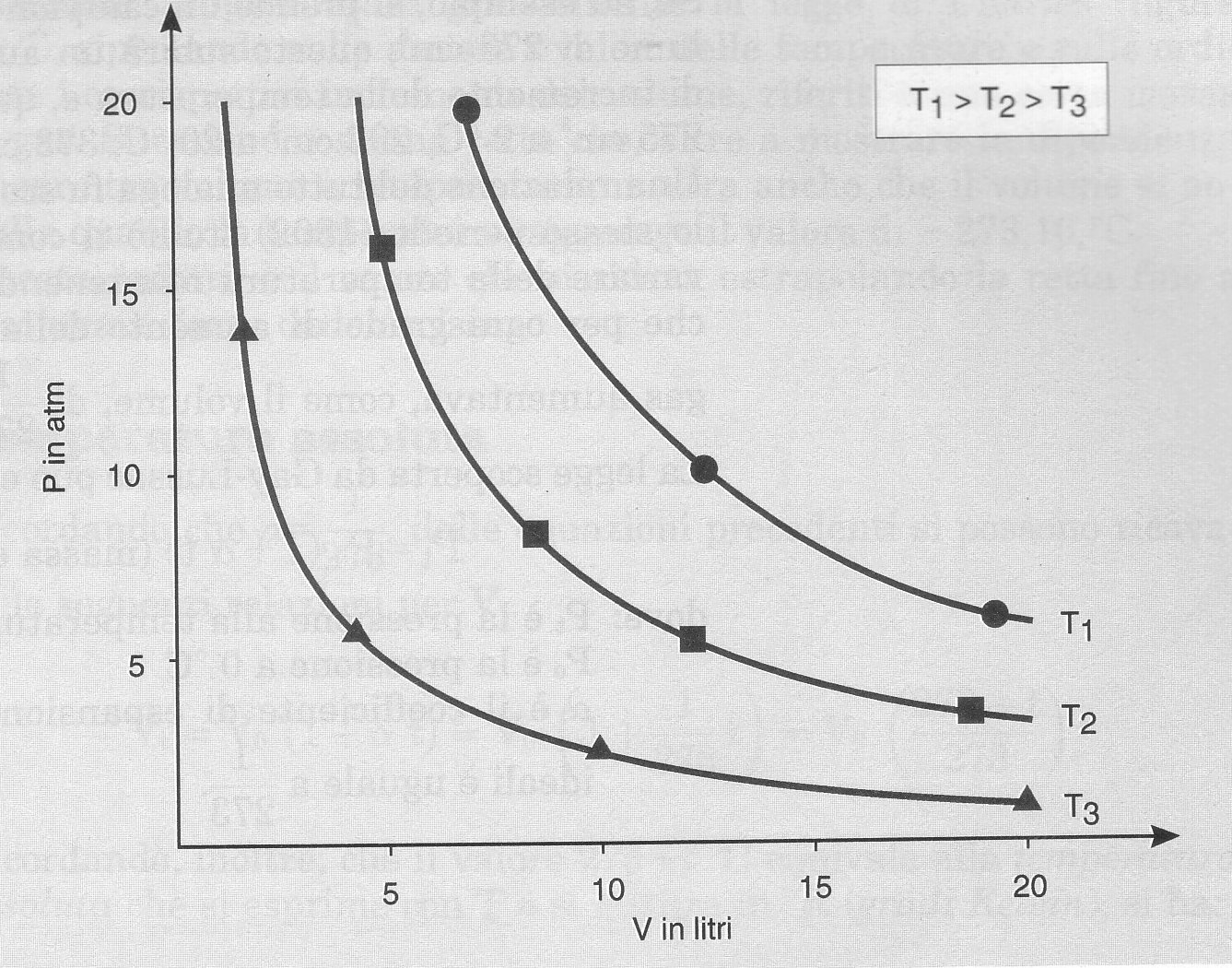
Le isoterme dei gas ideali sono iperboli (Fig. 1)
(Fig. 1)
22/11/2001; ore lezione: 14:30-16:30
Questo perché per una data massa di qualsiasi gas a temperatura costante, la pressione e il volume sono tra loro inversamente proporzionali. Questo è l’enunciato di BOYLE, il quale può essere riducibile in:
p × v = RT
dove p è la pressione assoluta espressa in Pa (Pascal) , v è il volume specifico espresso in ![]() , R è una costante che varia al variare dei gas e T è la temperatura espressa in K (gradi Kelvin)
, R è una costante che varia al variare dei gas e T è la temperatura espressa in K (gradi Kelvin)
|
GAS |
MASSA MOLECOLARE |
COSTANTE K |
|
O2 ossigeno |
32 |
260,83 |
|
H2idrogeno |
2 |
4126,4 |
|
N2 azoto |
28 |
296,91 |
tabella dei tre gas più conosciuti dove troviamo la loro massa molecolare m e R costante
.
![]()
n = numero di moli, M è la massa globale e m è la massa molecolare
p×
v×
m = RmT![]() p×
Vm = RmT
p×
Vm = RmT
Dove Vm è il volume molecolare e Rm è uguale a R0 dove R0 = 8,315 ![]()
In questo modo riusciamo a trovare la regola:
![]()
Che vale per tutti i gas
![]()
Dove n + vm = V
Allora p×
V = n R0T è la formula dei gas perfetti. R ![]()
22/11/2001; ore lezione: 14:30-16:30
Esempio riferito alla legge di Boyle:
ARIA: è una miscela di 75% d’azoto e di 25% d’ossigeno può essere considerato gas perfetto.
N2=75
O2=25
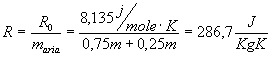
LEGGE DI GAY LUSSAC
Quando i solidi e i liquidi vengono riscaldati generalmente subiscono una deteriorazione. Tale fenomeno non segue, però, alcun’uniformità di comportamento e varia da sostanza a sostanza, per i gas, invece, tale uniformità di comportamento esiste ed è comune a tutte le sostanze purché allo stato aeriforme, infatti gia nel 1787 si osservò che qualunque massa gassosa di un qualunque gas, se riscaldata, subisce la stessa dilatazione totale in particolare risulta che per ogni grado d’aumento della temperatura il volume del gas aumenta di ![]() del volume che aveva a 0°C tale legge formalmente può essere scritta dalla relazione:
del volume che aveva a 0°C tale legge formalmente può essere scritta dalla relazione:
![]() Con massa e pressione costante.
Con massa e pressione costante.
Dove VT è il volume alla temperatura t1, V0 è il volume a 0°C, a è il coefficiente d’espansione termica.
![]()
D u =q-p D v
D h =q-vD p
Nel caso dei gas perfetti
![]()
![]()
Dove Q è costante.
Cv-cp=R
![]()
22/11/2001; ore lezione: 14:30-16:30
|
Sostanza |
Cp |
Cv |
|
H2O |
0,44 |
_- |
|
Aria |
0’01 |
0,717 |
|
H2 |
14,2 |
10,1 |
|
O2 |
0,917 |
0,656 |
D u = cpD T D h = cvD T
Esempio : u2= u1+cpD T
D
s =![]()
![]() =
=![]()
s2 -s1= cv ln![]() +R ln
+R ln ![]() s2 -s1= cv ln
s2 -s1= cv ln![]() +R ln
+R ln ![]()
Nel caso di una trasformazione adiabatica cioè non c’è scambio d’Energia con l’esterno.
p× (v)g =costante