![]() (13)
(13)
Sappiamo
inoltre che l’energia contenuta in un gas perfetto è data dall’equazione:
![]() (14)
(14)
Quindi:
![]() (15)
(15)
Mettendo
insieme le equazioni dei due stati del sistema avremo:
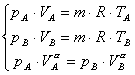 con
con ![]() (16)
(16)
Ricaviamo
così da questo sistema, prima
![]() (17)
(17)
e
poi ![]() (18)
(18)
unendo
questi risultati con la (15) avremo che il lavoro per il percorso c sarà
dunque:
![]() (19)
(19)
N.B: In tutti e tre i casi
comunque, la differenza ![]() sarà uguale; da
questo si può dedurre che il primo principio della termodinamica è una funzione
di stato, dipendente cioè non dal cammino percorso ma soltanto
dai due stati, iniziale e finale, della trasformazione!
sarà uguale; da
questo si può dedurre che il primo principio della termodinamica è una funzione
di stato, dipendente cioè non dal cammino percorso ma soltanto
dai due stati, iniziale e finale, della trasformazione!
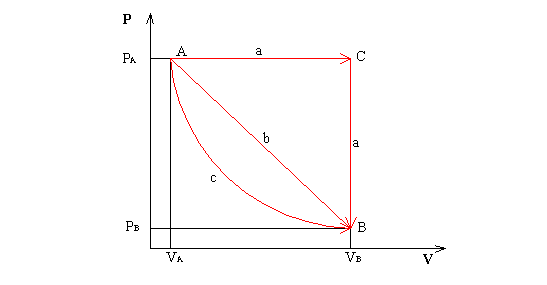
ESERCIZIO
Consideriamo
un cilindro contenente aria che passa da uno stato A ad uno stato B, nei tre
modi sopra citati.
Supponiamo
che siano:
pA = 32 bar = 3.200.000 Pa, VA = 1 m³, TA = 600 K
pB = 1 bar = 100.000 Pa, VB = 8 m³.
Calcoliamo
dunque la quantità di calore Q e il lavoro L per tutte e tre le trasformazioni:
c)
Ricaviamo, riscrivendo la (17) e la (18) con
i dati dell’esercizio, che:
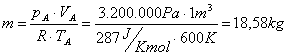 (20)
(20)
![]() (21)
(21)
Possiamo
dunque ricavare il lavoro compiuto nel percorso c, essendo ![]() :
:
![]()
(22)
Che sarà ovviamente di segno positivo poiché il
lavoro sarà compiuto dal sistema!
![]() (23)
(23)
b)
Per il percorso b il
lavoro, come visto sarà dato dall’area del trapezio, cioè:
![]() (24)
(24)
A questo punto sarà facile calcolare la quantità
di calore:
![]() (25)
(25)
c) Per questa trasformazione il lavoro sarà
invece dato dall’area del rettangolo che ha per lati VB – VA e PA; cioè:
![]() (26)
(26)
e quindi:
![]() (27)
(27)