TERMODINAMICA
Si definisce SISTEMA TERMODINAMICO, o semplicemente sistema, una porzione del mondo circostante che diventi oggetto della nostra osservazione e del nostro studio per ciò che riguarda le proprietà fisiche macroscopiche che lo contraddistinguono e le loro eventuali variazioni. Esempi di sistemi termodinamici sono un liquido in corso di ebollizione, un gas nel suo contenitore, la radiazione elettromagnetica contenuta in una cavità.
Esternamente al sistema termodinamico esiste un insieme di corpi che con esso interagiscono e che ne determinano lo stato e la sua evoluzione temporale, a cui è dato il nome di ambiente. Il sistema è separato dall’ambiente da una superficie geometrica, fissa o mutevole nel tempo, scelta dall’osservatore che costituisce il confine del sistema.
Se attraverso il confine del sistema avvengono scambi di materia e di energia con l’ambiente allora il sistema si dice aperto; se invece sono esclusi gli scambi di materia ma non quelli di energia il sistema è definito chiuso. Un sistema è termicamente isolato se può scambiare con l’ambiente energia meccanica, ma non energia termica, né materia. Infine si denomina isolato un sistema in cui, attraverso il suo confine, sono impediti sia gli scambi di materia che quelli di energia, cioè se le pareti che lo circondano sono nel contempo rigide, adiabatiche e impermeabili.
Tabella riassuntiva dei diversi tipi di sistemi termodinamici
|
Tipo di sistema |
Scambio di materia |
Scambio di calore |
Lavoro |
|
Aperto |
Sì |
Sì |
Sì |
|
Chiuso |
No |
Sì |
|
|
Termicamente isolato |
No |
No |
Sì |
|
Isolato |
No |
No |
No |
Il primo problema da affrontare studiando la termodinamica riguarda i trasferimenti di energia fra un sistema e l’ambiente. Tali trasferimenti avvengono attraverso delle trasformazioni in cui ha luogo un cambiamento di stato del sistema stesso. L’energia può essere trasferita attraverso un’alterazione di alcune proprietà fisiche macroscopiche del sistema quali il suo volume o la sua superficie: in questo caso il flusso viene chiamato lavoro. Ma suddetto trasferimento di energia fra sistema e ambiente può inoltre avvenire anche senza un’alterazione delle variabili estensive avendo il passaggio a livello atomico o molecolare poiché riguarda direttamente i moti delle particelle di cui è costituito il sistema: il flusso energetico viene chiamato calore.
Un’ulteriore importante variabile necessaria per caratterizzare lo stato di un sistema termodinamico è la temperatura, la cui definizione costringe ad introdurre il concetto di equilibrio.
Si considerino,
a tal proposito, due sistemi ![]() e
e ![]() a contatto e in
condizioni tali da non poter scambiare lavoro, ma in grado di scambiare energia
termica. Supponiamo inoltre che essi raggiungano una situazione in cui non abbia
luogo trasferimento di calore: in questo caso si trovano in equilibrio
termico. La stessa esperienza può essere ripetuta impiegando il sistema
a contatto e in
condizioni tali da non poter scambiare lavoro, ma in grado di scambiare energia
termica. Supponiamo inoltre che essi raggiungano una situazione in cui non abbia
luogo trasferimento di calore: in questo caso si trovano in equilibrio
termico. La stessa esperienza può essere ripetuta impiegando il sistema ![]() e un terzo sistema
e un terzo sistema ![]() che abbia le stesse
caratteristiche di
che abbia le stesse
caratteristiche di ![]() . È allora ragionevole dedurre che, se i sistemi (2) e (3)
sono ciascuno in equilibrio con (1), a loro volta si troveranno in condizioni
di reciproco equilibrio, ovvero se messi a contatto non avrà luogo
trasferimento di energia termica dall’uno all’altro.
. È allora ragionevole dedurre che, se i sistemi (2) e (3)
sono ciascuno in equilibrio con (1), a loro volta si troveranno in condizioni
di reciproco equilibrio, ovvero se messi a contatto non avrà luogo
trasferimento di energia termica dall’uno all’altro.
In altri termini,
“se
due sistemi sono separatamente in
equilibrio termico con terzo, essi sono anche in equilibrio termico fra loro”;
questo enunciato viene considerato lo
ZERESIMO
PRINCIPIO DELLA TERMODINAMICA.
È stato formulato dopo le due leggi della termodinamica da Fowler nel 1931, sebbene la proposta risalga a Maxwell. Il postulato zero giustifica l’uso del termoscopio e costituisce una delle basi della termodinamica: si scelga infatti nel postulato zero come terzo sistema un termoscopio, il postulato non esprime altro che l’affermazione che gli altri due sistemi, se in equilibrio termico col termoscopio, hanno la stessa temperatura, quella indicata dal termoscopio. Questo postulato perciò collega l’equilibrio termico alla definizione di uguaglianza della temperatura di due sistemi.
Si consideri
ora uno schema chiuso: si nota facilmente
che da una fase iniziale a una finale l’energia non rimane costante ma è
diversa. Si può dedurre perciò che se ![]() questo deriva da
flussi di energia spostatisi attraverso la pelle del sistema: in particolare
flussi di calore e di lavoro. È logico dunque pensare che nello stato fisico 2
è l’energia nello stato fisico 1 in cui si aggiunge il calore entrato e si
toglie del lavoro.
questo deriva da
flussi di energia spostatisi attraverso la pelle del sistema: in particolare
flussi di calore e di lavoro. È logico dunque pensare che nello stato fisico 2
è l’energia nello stato fisico 1 in cui si aggiunge il calore entrato e si
toglie del lavoro.
Da qui si ricava il PRIMO PRINCIPIO DELLA TERMODINAMICA,
definito
anche equazione fondamentale della termodinamica:
![]()
La prima legge della termodinamica è l’enunciato più generale del principio di conservazione dell’energia.
È noto infatti che le forze che agiscono a livello microscopico nell’iterazione tra atomi e molecole sono tutte conservative, da questo si può dedurre che la variazione dell’energia totale di un sistema può verificarsi solo per scambio di energia attraverso i suoi confini. In altre parole l’aumento o la diminuzione dell’energia del sistema è uguale alla quantità di energia che il sistema riceve da o cede all’ambiente. In particolare in un sistema chiuso l’energia scambiata si palesa in due sole forma: lavoro eseguito dalle forze esterne, e calore, energia trasmessa al sistema attraverso il “contatto termico” con altri corpi o attraverso fenomeni di radiazione.
Tenuto conto di queste considerazioni si possono così sintetizzare i risultati sperimentali osservati nelle trasformazioni di sistemi termodinamici chiusi:
“Qualunque sia il modo di
somministrare lavoro o calore ad un sistema, la somma delle energie
somministrate dipende solo dagli stati di equilibrio iniziale A e finale B del
sistema. Tale somma è uguale alla differenza dei valori assunti in B e in A da
una funzione caratteristica dello stato del sistema, con le dimensioni di una
energia, chiamata energia interna.”
Per un sistema chiuso si scrive dunque:
![]()
dove ![]() e
e ![]() sono rispettivamente
il lavoro eseguito dalle forze esterne e il calore entrato nel sistema (intesi
come quantità algebriche e perciò positive o negative) mentre
sono rispettivamente
il lavoro eseguito dalle forze esterne e il calore entrato nel sistema (intesi
come quantità algebriche e perciò positive o negative) mentre ![]() è la variazione di
energia interna
è la variazione di
energia interna ![]() . Quest’ultima è una funzione delle sole variabili di stato
del sistema in considerazione; in forma sintetica è una funzione di stato
del sistema.
. Quest’ultima è una funzione delle sole variabili di stato
del sistema in considerazione; in forma sintetica è una funzione di stato
del sistema.
Introducendo
il concetto di lavoro termodinamico ![]() (cioè il lavoro fatto
dal sistema,
(cioè il lavoro fatto
dal sistema, ![]() ) si usa scrivere l’equazione come
) si usa scrivere l’equazione come
![]()
Il primo
principio delle termodinamica fornisce la possibilità di quantificare i
fabbisogni energetici degli edifici che si costruiscono. Se ad esempio
desidero che le temperatura all’interno di una abitazione sia costantemente di ![]() gradi devo fornire
all’edificio una certa quantità di calore, un flusso incessante,
gradi devo fornire
all’edificio una certa quantità di calore, un flusso incessante, ![]() che deve essere
uguale a
che deve essere
uguale a ![]() , la temperatura che viene dispersa nell’ambiente. In questo
caso occorre ragionare in flussi di energia, cioè in energia nell’unità di
tempo, ovvero in potenza
, la temperatura che viene dispersa nell’ambiente. In questo
caso occorre ragionare in flussi di energia, cioè in energia nell’unità di
tempo, ovvero in potenza ![]() che si misura in
Watt. La variabile tempo è fondamentale in quanto i consumi di energia sono
distribuiti nel tempo.
che si misura in
Watt. La variabile tempo è fondamentale in quanto i consumi di energia sono
distribuiti nel tempo.
Va
notato inoltre che il contatore misura i ![]() (
(![]() ) cioè l’energia, non la potenza. Si paga infatti
l’energia ma quando si progetta un
impianto occorre parlare di potenza perché ogni secondo sarà necessario
produrre una certa quantità di energia. Questo accade in tutti gli impianti di
un edificio: riscaldamento, ventilazione, condizionamento.
) cioè l’energia, non la potenza. Si paga infatti
l’energia ma quando si progetta un
impianto occorre parlare di potenza perché ogni secondo sarà necessario
produrre una certa quantità di energia. Questo accade in tutti gli impianti di
un edificio: riscaldamento, ventilazione, condizionamento.
ESEMPIO 1
Si consideri
un edificio di forma cubica, lato ![]() , appoggiato su pilots in modo che la dispersione di calore
sia uguale su tutte le facce. La sua superficie complessiva è
, appoggiato su pilots in modo che la dispersione di calore
sia uguale su tutte le facce. La sua superficie complessiva è ![]() . All’interno si vuole mantenere un temperatura costante
. All’interno si vuole mantenere un temperatura costante ![]() mentre la temperatura
esterna è
mentre la temperatura
esterna è ![]() in base alla legge 10
del 1991(vedi approfondimento). L’involucro inoltre presenta una finestra di
in base alla legge 10
del 1991(vedi approfondimento). L’involucro inoltre presenta una finestra di ![]() su quattro facce e
niente sulle altre due; si ha perciò che
su quattro facce e
niente sulle altre due; si ha perciò che ![]() mentre
mentre ![]() . Si supponga inoltre che il muro sia di mattoni a due teste
e di spessore complessivo pari a 32 cm (25 cm per il mattone, 5 cm di isolante
e 3 cm di rivestimento esterno).
. Si supponga inoltre che il muro sia di mattoni a due teste
e di spessore complessivo pari a 32 cm (25 cm per il mattone, 5 cm di isolante
e 3 cm di rivestimento esterno).
Si supponga
che per un mattone pieno ![]() .
.
L’edificio presenta inoltre delle finestre con telaio in alluminio e vetrocamera (vetro doppio costituito da due lastre associate con in mezzo uno strato isolante e deumidificante) costituito da una lastra di vetro di 4 mm, uno spessore di aria intermedio di 12 mm e un’altra lastra di vetro di 6 mm. Le due lastre comunemente non hanno lo stesso spessore sia per motivi acustici (se le due lastre hanno lo stesso spessore le frequenze di risonanza sono uguali e di conseguenza le due lastre vibrano contemporaneamente e nello stesso modo perciò passano tutti i rumori), sia per motivi di sicurezza ( la lastra di spessore maggiore deve essere verso l’esterno).
Il
coefficiente globale di scambio termico delle finestre è ![]()
Ora si posseggono tutti i dati per calcolare la potenza termica complessiva:
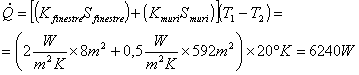
Gli impianti
elettrici normali hanno una potenza massima pari a ![]() : esiste infatti un limitatore sulla potenza massima
istantanea.
: esiste infatti un limitatore sulla potenza massima
istantanea.
Supponendo
che ![]() costa 200 lire
scaldare la casa per 6 mesi costerà
costa 200 lire
scaldare la casa per 6 mesi costerà
![]()
![]()
![]()
EQUAZIONE DEI GAS PERFETTI
Se si comprime un gas mantenendo costante la sua temperatura si trova che la pressione aumenta al diminuire del volume; se si lascia espandere un gas, la sua pressione diminuisce all’aumentare del volume. Si può perciò dire che un gas è inversamente proporzionale al suo volume; questo comporta che, a temperatura costante, il prodotto tra la pressione di un gas e il suo volume è costante.
![]()
Questo risultato sperimentale è
noto come legge di Boyle e vale con buona approssimazione per tutti i
gas a bassa pressione; infatti in questi gas il prodotto ![]() è circa proporzionale
alla temperatura
è circa proporzionale
alla temperatura ![]()
![]()
dove ![]() è una costante di
proporzionalità che dipende dalla quantità di gas.
è una costante di
proporzionalità che dipende dalla quantità di gas.
La pressione
esercitata da un gas sulle pareti del suo recipiente è il risultato degli urti
delle molecole del gas contro le pareti. Perciò se si raddoppia il numero delle
molecole di un gas in un dato recipiente, si raddoppia il numero di urti che
hanno luogo in un certo intervallo di tempo e, di conseguenza, si raddoppia la
pressione. Ci si aspetta quindi che la costante ![]() dell’equazione
precedente sia direttamente proporzionale al numero di molecole del gas
contenuto nel recipiente:
dell’equazione
precedente sia direttamente proporzionale al numero di molecole del gas
contenuto nel recipiente:
![]()
dove ![]() è il numero di
molecole del gas e
è il numero di
molecole del gas e ![]() è una costante
chiamata costante di Boltzmann che, si è trovato sperimentalmente, ha lo
stesso valore per qualsiasi tipo e per qualsiasi quantità di gas (
è una costante
chiamata costante di Boltzmann che, si è trovato sperimentalmente, ha lo
stesso valore per qualsiasi tipo e per qualsiasi quantità di gas (![]() ).
).
Si ha quindi
![]()
Spesso però
conviene esprimere la quantità de gas in base al numero di moli: una mole di
una qualsiasi sostanza è la quantità di quella sostanza che contiene il numero
di Avogadro di atomi o di molecole (definendo con numero di Avogadro ![]() come il numero di
atomi di carbonio in 12 g di
come il numero di
atomi di carbonio in 12 g di ![]() e vale
e vale
![]()
infatti se abbiamo n moli di una sostanza, il numero di molecole è
![]()
l’equazione allora diventa
![]()
dove ![]() è chiamata costante
universale dei gas ed il suo valore è lo stesso per tutti i gas
è chiamata costante
universale dei gas ed il suo valore è lo stesso per tutti i gas ![]()
L’equazione
![]()
è detta EQUAZIONE DEI GAS PERFETTI,
intendendo
con gas perfetto un gas per cui ![]() è costante a tutte le pressioni, mentre per i gas reali
questo rapporto è notevolmente costante in un intervallo di pressioni piuttosto
grandi. Questa equazione si applica a un gas perfetto un concetto che è un
estrapolazione del comportamento dei gas reali a bassa pressione al
comportamento dei gas perfetti. Infatti a pressioni ragionevolmente basse molti
gas si discostano poco dal comportamento di un gas perfetto.
è costante a tutte le pressioni, mentre per i gas reali
questo rapporto è notevolmente costante in un intervallo di pressioni piuttosto
grandi. Questa equazione si applica a un gas perfetto un concetto che è un
estrapolazione del comportamento dei gas reali a bassa pressione al
comportamento dei gas perfetti. Infatti a pressioni ragionevolmente basse molti
gas si discostano poco dal comportamento di un gas perfetto.
CAPACITA TERMICA
La quantità
di energia termica ![]() necessaria per
aumentare la temperatura di una sostanza è direttamente proporzionale alla
variazione di temperatura e alla massa della sostanza:
necessaria per
aumentare la temperatura di una sostanza è direttamente proporzionale alla
variazione di temperatura e alla massa della sostanza:
![]()
dove ![]() è la capacità termica
di una sostanza ed è definita come l’energia necessaria per aumentare di un
grado la sua temperatura. L’unità di misura storica dell’energia termica, la
caloria, fu definita come la quantità di energia termica necessaria per
aumentare di
è la capacità termica
di una sostanza ed è definita come l’energia necessaria per aumentare di un
grado la sua temperatura. L’unità di misura storica dell’energia termica, la
caloria, fu definita come la quantità di energia termica necessaria per
aumentare di ![]() la temperatura di
la temperatura di ![]() di acqua. Ma poiché
ora sappiamo che l’energia termica è solo un'altra forma di energia oggi la caloria viene definita per mezzo dell’unità
SI dell’energia, il Joule:
di acqua. Ma poiché
ora sappiamo che l’energia termica è solo un'altra forma di energia oggi la caloria viene definita per mezzo dell’unità
SI dell’energia, il Joule:
![]()
Il
calore specifico ![]() invece è la capacità
termica riferita all’unità di massa,
invece è la capacità
termica riferita all’unità di massa,
![]()
La quantità di calore necessaria per aumentare la temperatura di un corpo dipende dal fatto che si lasci, o meno, espandere la sostanza mentre la sua temperatura aumenta. Se si lascia espandere, essa compirà lavoro sull’ambiente esterno, e sarà richiesto più calore per compiere il lavoro, oltre che per aumentare la temperatura. È molto difficile impedire ad un solido o a liquido di espandersi quando vengono riscaldati e la pressione sulla sostanza di solito è costante durante il riscaldamento.
Per i gas la
pressione può essere costante durante il riscaldamento o il raffreddamento
(esempio dell’aria riscaldata in una casa) oppure il gas può venire riscaldato
in un contenitore chiuso a volume costante (ad esempio nei laboratori). In
quest’ultimo caso il gas non compie lavoro e il calore specifico ![]() è minore di quello a
pressione costante
è minore di quello a
pressione costante ![]() . Se per i gas questa differenza è grande, per i solidi ed i
liquidi invece è tanto piccola da poter essere trascurata.
. Se per i gas questa differenza è grande, per i solidi ed i
liquidi invece è tanto piccola da poter essere trascurata.
Se si
fornisce calore a un gas a volume costante, nessun lavoro è compiuto dal
gas o su di esso, e quindi il calore fornito è uguale all’aumento di energia
interna del gas. Chiamando ![]() il calore fornito a
volume costante si ha
il calore fornito a
volume costante si ha
![]()
ma per il primo principio della termodinamica
![]() perché
perché ![]()
perciò
![]()
Se invece
forniamo calore a pressione costante il gas si espanderà e compirà
lavoro sull’ambiente esterno: solo una parte del calore contribuirà all’aumento
dell’energia interna del gas. Se chiamiamo ![]() il calore fornito a
pressione costante si ha
il calore fornito a
pressione costante si ha
![]()
dal primo principio della termodinamica
![]()
quindi
![]()
La pressione, il volume e la temperatura di un gas perfetto sono legati dalla relazione
![]()
![]()
e semplificando
![]()
ESEMPIO 2
Si consideri
ora che la stessa casa dell’esempio 1, con ![]() , sia inizialmente fredda: appena inizia a riscaldarsi inizia
anche a disperdere verso l’esterno. La temperatura interna iniziale è di
, sia inizialmente fredda: appena inizia a riscaldarsi inizia
anche a disperdere verso l’esterno. La temperatura interna iniziale è di ![]() e deve raggiungere la
temperatura finale di
e deve raggiungere la
temperatura finale di ![]() .
.
Si noti che
all’inizio la transizione termica è nulla (![]() )mentre nella fase finale è di
)mentre nella fase finale è di ![]() , come è stato calcolato nell’esempio precedente. Risulta
evidente che
, come è stato calcolato nell’esempio precedente. Risulta
evidente che ![]() : inizialmente tutta la potenza
: inizialmente tutta la potenza ![]() viene impiegata a
scaldare l’ambiente mentre successivamente tende a disperdersi. Proprio per
questo motivo il grafico (temperatura, variazione di tempo) è una curva che
presenta asintoto orizzontale: per riscaldare dei primi gradi impiega poco
tempo ma se fornisco al sistema la temperatura strettamente necessaria a
raggiungere i
viene impiegata a
scaldare l’ambiente mentre successivamente tende a disperdersi. Proprio per
questo motivo il grafico (temperatura, variazione di tempo) è una curva che
presenta asintoto orizzontale: per riscaldare dei primi gradi impiega poco
tempo ma se fornisco al sistema la temperatura strettamente necessaria a
raggiungere i ![]() questo valore verrà
raggiunto solo dopo un tempo infinito. Occorre perciò fornire una potenza tale
che l’asintoto si formi ad una temperatura maggiore dei
questo valore verrà
raggiunto solo dopo un tempo infinito. Occorre perciò fornire una potenza tale
che l’asintoto si formi ad una temperatura maggiore dei ![]() dai noi desiderati;
solo in questo modo posso calcolare il tempo impiegato per riscaldare la
stanza. Fornisco perciò al sistema una potenza termica
dai noi desiderati;
solo in questo modo posso calcolare il tempo impiegato per riscaldare la
stanza. Fornisco perciò al sistema una potenza termica ![]() , invece dei
, invece dei ![]() prima calcolati.
prima calcolati.
Ipotizzo inoltre che il riscaldamento iniziale rimanga costante e
che il sistema inizi a disperdere solamente dopo che l’ambiente si è
riscaldato. Questo è simile alla realtà in quanto il muro di mattoni
inizialmente si scalda solo un sottile strato superficiale (mentre l’aria
dell’ambiente è già a ![]() ); la stanza si è scalda in un tempo rapido ed essendo il
muro ancora freddo la dispersione non è ancora iniziata.
); la stanza si è scalda in un tempo rapido ed essendo il
muro ancora freddo la dispersione non è ancora iniziata.
A questo punto ci si può domandare quanto tempo occorre a scaldare questa quantità d’aria.
Un ![]() d’aria pesa circa
d’aria pesa circa ![]() perciò la massa
dell’aria dell’edificio è di
perciò la massa
dell’aria dell’edificio è di ![]() (
(![]() ). È noto inoltre che la capacità termica specifica dell’
aria a volume costante è
). È noto inoltre che la capacità termica specifica dell’
aria a volume costante è ![]() ; mentre quella a pressione costante, dove cioè l’aria è
libera di espandersi, è
; mentre quella a pressione costante, dove cioè l’aria è
libera di espandersi, è ![]() . In quest’ultimo caso l’aria espandendosi compie lavoro e
perciò occorre più calore.
. In quest’ultimo caso l’aria espandendosi compie lavoro e
perciò occorre più calore.
In questo esempio ci si ponga nel caso in cui la capacità termica è a volume costante pensando che l’edificio resista perciò alla pressione. La quantità di energia che occorre è
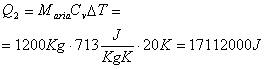
Dato che ogni secondo fornisco 9000 J il tempo di riscaldamento
![]()
Per curiosità può essere anche calcolato il costo che è di
![]()
ESERCIZIO 3
Si supponga ora che l’aria sia libera di espandersi e che di conseguenza rimanga costante la pressione. Il calcolo chiaramente risulta simile a quello svolto precedentemente
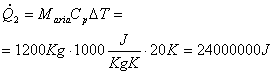
![]()
Il maggior calore fornito si è dunque trasformato in lavoro. Per capire quanto vale si supponga che l’aria sia contenuta in un pistone con uno stantuffo
![]() ; dove
; dove ![]() è la forza.
è la forza.
Se valuto i
due volumi come ![]() volume iniziale e
volume iniziale e ![]() volume finale posso
sostenere che
volume finale posso
sostenere che ![]() in quanto il pistone
è salito e di conseguenza è avvenuta una variazione di volume. Da questo si
ricava che il lavoro può essere anche scritto
in quanto il pistone
è salito e di conseguenza è avvenuta una variazione di volume. Da questo si
ricava che il lavoro può essere anche scritto
![]()
Per calcolare il volume finale occorre infine utilizzare l’equazione dei gas perfetti
![]()
dove p = pressione atmosferica normale = 101325 Pascal ed R
vale ![]()
Posso perciò ricavare la massa
![]()
Essendo la temperatura più bassa, l’aria è più densa perciò a parità di volume entra più aria.. Una volta ricavata la massa applico nuovamente l’equazione dei gas perfetti ed ottengo il volume finale.
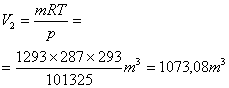
Il lavoro è
![]()
ed è uguale alla quantità di calore fornita in eccesso.
APPROFONDIMENTO
ISOLAMENTO TERMICO E RISPARMIO ENERGETICO
I primi provvedimenti legislativi per limitare i consumi
energetici hanno origine dalla crisi energetica degli anni Settanta. Secondo
questi provvedimenti, tra cui la legge 373/76, i componenti da impiegare nella
costruzione degli elementi, che contengono materiali isolanti, ovvero i
materiali isolanti in vista devono presentare un comportamento al fuoco idoneo
in relazione al loro inserimento nelle strutture e al tipo e destinazione
dell’edificio.
A questi provvedimenti hanno fatto seguito la legge 308/82 e successivamente in ambito del Piano Energetico Nazionale la legge 9/91 e la legge 10/91 e il DPR 412/93 che è un Decreto Attuativo.
Conseguentemente agli sviluppi legislativi anche la normativa tecnica si è andata modificando come dimostrano le norme UNI di recente pubblicazione.
La legge
n.9 del 9 gennaio 1991 contiene la “norme per l’attuazione del nuovo
piano energetico nazionale: aspetti istituzionali, centrali idroelettriche ed
elettrodotti, idrocarburi e geotermia, autoproduzione e disposizioni fiscali”
mentre la legge n. 10 dello stesso anno, apparsa sulla gazzetta
ufficiale il 16 gennaio 1991, prevede delle “norme per l’attuazione del
Piano energetico nazionale in materia di uso razionale dell’energia, di
risparmio energetico e di sviluppo delle fonti rinnovabili di energia”.
LEGGE 10/91
Nel primo articolo di questa legge viene specificato che queste norme mirano, in accordo con la politica energetica della Comunità economica Europea, a “migliorare i processi di trasformazione dell’energia, a ridurre i consumi di energia e a migliorare le condizioni di compatibilità ambientale dell’utilizzo dell’energia a parità di servizio reso e di qualità della vita” favorendone così l’uso razionale,il contenimento dei consumi, l’utilizzo di fonti rinnovabili. In particolare vengono considerate fonti rinnovabili di energia “il sole, il vento, l’energia idraulica, le risorse geotermiche, le maree, il moto ondoso e la trasformazione dei rifiuti organici ed inorganici. Sono considerate altresì fonti di energia assimilate alle fonti rinnovabili di energia: la cogenerazione, intesa come produzione combinata di energia elettrica o meccanica e di calore, il calore recuperabile nei fumi di scarico e da impianti termici” elettrici ed industriali.
L’articolo 4 recita inoltre che “entro centottanta giorni dalla data di entrata in vigore della presente legge, con decreto del Presidente della Repubblica, (…) sono emanate norme per il contenimento dei consumi di energia, riguardanti in particolare progettazione, installazione, esercizio e manutenzione degli impianti termica, e i seguenti aspetti: determinazione delle zone climatiche; durata giornaliera di attivazione nonché periodi di accensione degli impianti termici; temperatura massima dell’aria negli ambienti degli edifici durante il funzionamento degli impianti termici; rete di distribuzione e adeguamento delle infrastrutture di trasporto, di ricezione e di stoccaggio delle fonti di energia al fine di favorirne l’utilizzazione da parte degli operatori pubblici e privati per le finalità” di cui si è parlato precedentemente.
Inoltre “con decreto del Presidente della Repubblica, da emanarsi entro centottanta giorni dalla data di entrata in vigore della presente legge, sono emanate norme idonee a rendere apprezzabile il conseguimento dell’obbiettivo dell’uso razionale dell’energia e dell’utilizzo di fonti rinnovabili di energia nei criteri di aggiudicazione delle gare di appalto “.
Nella legge n 10 vi è anche un serie di articoli che regolamentano la concessione di finanziamenti “al fine di incentivare la realizzazione di iniziative volte a ridurre il consumo specifico di energia, il miglioramento dell’efficienza energetica, l’utilizzo di fonti di energia” rinnovabili.
DPR 412/93
Col Decreto
del Presidente della Repubblica n. 412
del 26 agosto 1993, pubblicato sulla Gazzetta Ufficiale il 14 ottobre 1993,
viene emanato un “regolamento recante norme per la progettazione,
l’installazione, l’esercizio e la manutenzione degli impianti termici degli
edifici ai fini del contenimento dei consumi di energia, in attuazione
dell’atr. 4, comma 4, della legge 9 gennaio 1991, n.10”.
Nell’articolo 2 di questo decreto vengono individuate sei zone climatiche “in funzione dei gradi-giorno di un località, indipendentemente dall’ubicazione geografica”.
Per gradi-giorno si intenda, come recita il decreto nell’articolo 1, “la somma, estesa a tutti i giorni di un periodo annuale convenzionale di riscaldamento, delle solo differenze positive giornaliere tra la temperatura dell’ambiente, convenzionalmente fissata a 20°C, e la temperatura media esterna giornaliera; l’unità di misura utilizzata è il grado giorno (GG)”.
- Zona A: comuni che presentano un numero di gradi – giorno non superiore a 600
- Zona B: comuni che presentano un numero di gradi – giorno maggiore di 600 e non superiore a 900
- Zona C: comuni che presentano un numero di gradi – giorno maggiore di 900 e non superiore a 1400
- Zona D: comuni che presentano un numero di gradi – giorno maggiore di 1400 e non superiore a 2100
- Zona E: comuni che presentano un numero di gradi – giorno maggiore di 2100 e non superiore a 3000
- Zona F: comuni che presentano un numero di gradi – giorno maggiore di 3000
Tabella esemplificativa
|
Località |
Te Progetto (°C) |
Zona climatica |
Durata Riscaldamento (giorni) |
Gradi Giorno |
|
Agrigento |
3 |
B |
121 |
729 |
|
Alessandria |
-8 |
E |
183 |
2559 |
|
Ancona |
-2 |
D |
166 |
1688 |
|
Aosta |
-10 |
E |
183 |
2850 |
|
Bari |
0 |
C |
137 |
1185 |
|
Belluno |
-10 |
E |
183 |
2936 |
|
Bologna |
-5 |
E |
183 |
2259 |
|
Bolzano |
-15 |
E |
183 |
2791 |
|
Cagliari |
3 |
C |
137 |
990 |
|
Catania |
5 |
B |
121 |
833 |
|
Como |
-5 |
E |
183 |
2228 |
|
Firenze |
0 |
D |
166 |
1821 |
|
Forlì |
-5 |
D |
166 |
2087 |
|
Genova |
0 |
D |
166 |
1435 |
|
Lecce |
0 |
C |
137 |
1153 |
|
Milano |
-5 |
E |
180 |
2404 |
|
Napoli |
2 |
C |
137 |
1034 |
|
Novara |
-5 |
E |
183 |
2463 |
|
Padova |
-5 |
E |
183 |
2383 |
|
Palermo |
5 |
B |
122 |
751 |
|
Perugia |
-2 |
E |
183 |
2289 |
|
Pescara |
2 |
D |
166 |
1718 |
|
Pesaro |
-2 |
D |
166 |
2083 |
|
Ravenna |
-5 |
E |
183 |
2227 |
|
Reggio C. |
3 |
B |
121 |
772 |
|
0 |
D |
166 |
1415 |
|
|
Torino |
-5 |
E |
183 |
2617 |
|
Trento |
-12 |
E |
183 |
2567 |
|
Trieste |
-5 |
D |
166 |
1929 |
|
Venezia |
-5 |
E |
183 |
2345 |
“Durante il periodo in cui è in funzione l’impianto di climatizzazione invernale, la media aritmetica delle temperature dell’aria dei singoli ambienti degli edifici, non deve superare i seguenti valori con le tolleranze a fianco indicate:
a) 18°C + 2° C di tolleranza per gli edifici rientranti nella categoria E.8 (sono gli edifici adibiti ad attività industriali ed artigianali);
b) 20° C + 2° C di tolleranza per gli edifici rientranti nelle categorie diverse da E.8.
Il mantenimento della temperatura dell’aria negli ambienti entro i limiti sopra fissati deve essere ottenuto con accorgimenti che non comportino spreco di energia.
Gli impianti termici di nuova installazione nonché quelli sottoposti a ristrutturazione devono essere dimensionati in modo da assicurare, in relazione a:
- il valore massimo della temperatura interna previsto
- le caratteristiche climatiche della zona
- le caratteristiche termofisiche dell’involucro edilizio
- il regime di conduzione dell’impianto in base agli obblighi di intermittenza-attenuazione
un “rendimento globale medio stagionale” non inferiore al seguente valore
![]()
dove ![]() è il logaritmo in
base 10 della potenza utile nominale del generatore o del complesso dei
generatori di calore al servizio del singolo impianto termico, espressa in kW.
Il “rendimento globale medio stagionale” dell’impianto termico è definito come
rapporto tra il fabbisogno di energia termica utile per la climatizzazione
invernale e l’energia primaria delle fonti energetiche.
è il logaritmo in
base 10 della potenza utile nominale del generatore o del complesso dei
generatori di calore al servizio del singolo impianto termico, espressa in kW.
Il “rendimento globale medio stagionale” dell’impianto termico è definito come
rapporto tra il fabbisogno di energia termica utile per la climatizzazione
invernale e l’energia primaria delle fonti energetiche.
Nel’articolo 9 del decreto vengono inoltre fissati i limiti di esercizio degli impianti termici; il comma 2 infatti recita: “l’esercizio degli impianti termici è consentito con i seguenti limiti massimi relativi al periodo annuale di esercizio dell’impianto ed alla durata giornaliera di attivazione:
- Zona A: ore 6 giornaliere dal 1° dicembre al 15 marzo;
- Zona B: ore 8 giornaliere dal 1° dicembre al 31 marzo;
- Zona C: ore 10 giornaliere dal 15 novembre al 31 marzo;
- Zona D: ore 12 giornaliere dal 1° novembre al 15 arpile;
- Zona E: ore 14 giornaliere dal 15 ottobre al 15 aprile;
- Zona F: nessuna limitazione.
Al di fuori di tali periodi gli impianti termici possono essere attivati solo in presenza di situazioni climatiche che ne giustifichino l’esercizio e comunque con una durata giornaliera non superiore alla metà di quella consentita a pieno regime. È consentito il fraziionametno dell’orario di riscaldamento in due o più sezioni. La durata di attivazione degli impuianti non ubicati nella zona F deve essere comunque compresa tra le ora 5 e le ore 23 di ciascun giorno”.
Il decreto si conclude infine con le norme per l’esercizio e la manutenzione degli impianti termici e dei relativi controlli