Elisa Adorni matr.138689 Lezione del 22/10/2001 ore 14.30-16.30
Prima di parlare del concetto di gas perfetto è bene introdurre qualche nozione di chimica.
L’atomo è la più piccola parte di un elemento che ne conserva le caratteristiche chimiche e fisiche. L’atomo è costituito da piccolissime particelle (particelle sub-atomiche): protoni con carica positiva (+1), elettroni con carica negativa (-1) e neutroni con carica neutra (0). I protoni e i neutroni costituiscono il nucleo dell’atomo e gli elettroni si trovano a distanza molto elevata dal nucleo. In questo modo gli orbitali che hanno carica negativa sono attratti dal nucleo che è caricato positivamente ed è tenuto compatto dai neutroni.

Figura 1 – Schema di un atomo
L’ordine di grandezza delle masse è
-protone:
1,673x 10![]() kg
kg
-neutrone:
1,675x10![]() kg
kg
-elettrone:
9,11x 10![]() kg
kg
La carica dell’elettrone è uguale alla carica del protone. Tutti gli elementi finora noti sono ordinati nella tavola periodica degli elementi in ordine di peso atomico crescente, mettendo in colonna quelli aventi proprietà chimiche simili. Nelle tabelle periodiche viene indicato il numero di elettroni della materia che si indica con Z . Con N viene indicato invece il numero dei nucleoni, cioè il numero dei protoni sommato al numero dei neutroni. La massa di un atomo è dato dal numero dei nucleoni N. L’atomo normalmente è neutro e assume carica nelle reazioni chimiche.
In natura vi sono 95 tipi di atomi, si sale a 100 se si considerano anche gli atomi ottenuti in laboratorio.
La molecola è una combinazione di atomi che forma la più piccola unità di cui è costituita una sostanza. Per esempio l’acqua è una molecola composta da due atomi di idrogeno (H) e uno di ossigeno (O)
H2O → scomponendola ottengo → idrogeno (H) e ossigeno (O)
Il legame molecolare dell’acqua è dato dall’unione delle singole molecole di
H2O
H2O — H2O
Nei gas invece le molecole sono staccate come biglie indipendenti slegate una dall’altra.
Le molecole di un gas possono essere:
-monoatomiche: composte da un solo atomo
-biatomiche: composte da più atomi (per esempio l’acqua).
Esempi di gas biatomici:
Ossigeno (O2 ) composto da 2 atomi di ossigeno
Azoto (N2 ) composto da 2 atomi di azoto
Metano (CH4 ) composto da 1 atomo di carbonio e 4 atomi di idrogeno
Il metano è un gas che si trova in natura e viene utilizzato come combustibile.
Figura 2 - Disposizione tetraedrica di una molecola di metano
Introduciamo ora il concetto di reazione chimica che è il processo che provoca la trasformazione di sostanze in altre, cioè il modificarsi delle specie molecolari.
Un esempio di reazione è la combustione del metano:
![]() (1)
(1)
in questa reazione viene liberata energia E che era trattenuta dal punto di vista
chimico in CH4 + 2O2.
Esistono reazioni esotermiche, che rilasciano energia, e reazioni endotermiche,che sottraggono energia all’ambiente.
La combustione del metano è una reazione esotermica, mentre un esempio di reazione endotermica è
![]() (2)
(2)
il calore E viene usato per la trasformazione.
Un altro esempio è la reazione nella pila a combustione che sfrutta le reazioni chimiche per dar luogo ad energia elettrica.
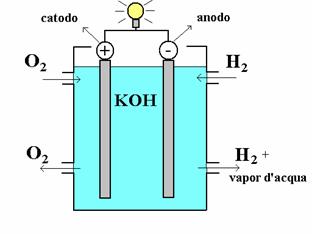
Figura 3 - Pila a combustione
La pila a combustione è composta da due elettrodi ferrosi (l’anodo e il catodo), sui quali avverrà la reazione, che sono immersi in un elettrolita composto da idrossido di potassio (KOH) nel quale verranno introdotti ossigeno (O2) e idrossido (H2). Mentre avviene la reazione si disperde energia che viene utilizzata per accendere la lampadina.
Scriviamo ora le reazioni che avvengono sul catodo (+) e sull’anodo (-):
(-) ![]() (3)
(3)
(+) ![]() (4)
(4)
Quindi la reazione che avviene in una pila a combustione è
![]() (5)
(5)
la reazione può avvenire sia in una senso che nell’altro, come accade anche in una cella elettrolitica in cui gli elettrodi sono collegati ad una generatore di energia elettrica

Figura 4 - Cella elettrolitica
Vicino agli elettrodi si formano delle bollicine, causate da idrogeno e ossigeno che si spezzano e si liberano sotto forma di gas.
Le reazioni sul catodo (+) e l’anodo (-) sono
(-) ![]() (8)
(8)
(+) ![]() (7)
(7)
Un’altra grandezze di massa per misurare le sostanze chimiche è la mole
1 mole di sostanza = 6,02x10²³ molecole di quella sostanza.
dove 6,02x10²³ è il
numero di Avogadro NA.
Numericamente la mole si ottiene esprimendo in grammi il peso molecolare (o atomico) della sostanza. Per esempio nell’acqua il peso molecolare è dato dal
peso atomico dell’idrogeno =1
Figura 5 – Schema dell’atomo di idrogeno
sommato al peso atomico dell’ossigeno =16

Figura 6 – Schema dell’atomo di ossigeno
quindi il peso atomico dell’acqua è
![]() = 16+1+1=18
= 16+1+1=18
Dato che la mole è il peso atomico espresso in grammi una mole d’acqua è uguale a 18 g d’acqua.
Per l’ossigeno il peso atomico è
![]() =16+16=32
=16+16=32
quindi una mole di ossigeno è uguale a 32 g d’acqua.
Come unità di misura viene utilizzata anche il kmole,
1kmole = 1000· (6,02x10²³ ) molecole .
Dopo questa breve introduzione di chimica passiamo al concetto di gas ideale.
Per descrivere il comportamento di un gas si ricorre al concetto di gas perfetto che è un modello di comportamento a cui tendono i gas reali in condizione di grande rarefazione (alta temperatura e bassa pressione).

Figura 7 - Le particelle che costituiscono il gas sono cosi distanti da non interagire tra di loro.
Nel diagramma pressione-volume ( Fig.8 ) i gas perfetti si collocano nella zona di maggiore rarefazione (in basso a destra ). Le isoterme hanno l’andamento di iperboli equilatere.

Figura 8 - Diagramma pressione-volume
![]() (8)
(8)
Dove p è la pressione ( Pa
), v è il volume specifico in m³ /
Kg, T è la temperatura assoluta in
gradi Kelvin (K) e R è una costante che cambia in funzione del gas. Introducendo il
numero di Avogadro (![]() = 6,02 x 10²³, numero di atomi o di molecole contenuti in
una mole ) e il concetto di mole si può trovare una formula generica.
= 6,02 x 10²³, numero di atomi o di molecole contenuti in
una mole ) e il concetto di mole si può trovare una formula generica.
![]() (9)
(9)
Relazione che dà il numero di moli in M grammi di sostanza di massa molare m, moltiplicando entrambi i membri dell’equazione (8) per m ottengo
![]() (10)
(10)
dove vm è il volume specifico molare e ![]() = 8,315 J/ mol K
valore della costante universale dei gas. L’equazione può dunque essere
riscritta come
= 8,315 J/ mol K
valore della costante universale dei gas. L’equazione può dunque essere
riscritta come
![]() (11)
(11)
Moltiplicando entrambi i membri per n ottengo l’equazione generale di stato dei gas perfetti
![]() (12)
(12)
Dove V è il volume totale del contenitore dato da ![]() .
.
I valori di m
e di R, legati alla relazione ![]() , sono riportati per alcune sostanze nella seguente tabella
, sono riportati per alcune sostanze nella seguente tabella
|
Sostanza |
Formula |
m ( kg/kmol) |
R (J/kg
K) |
|
Acetilene |
C2H2 |
26,039 |
319,43 |
|
Acqua |
H2O |
18,016 |
461,70 |
|
Ammoniaca |
NH3 |
17,032 |
488,38 |
|
Anidride carbonica |
CO2 |
44,012 |
188,99 |
|
Anidride solforosa |
SO2 |
64,066 |
129,83 |
|
Argon |
Ar |
39,950 |
208,21 |
|
Aria |
|
28,968 |
287,13 |
|
Azoto |
N2 |
28,014 |
296,91 |
|
Elio |
He |
4,0028 |
2078,0 |
|
Etano |
C2H6 |
30,071 |
276,60 |
|
Etilene |
C2H4 |
28,055 |
296,48 |
|
Freon |
12CCl2F2 |
120,914 |
68,77 |
|
Idrogeno |
H2 |
2,0158 |
4126,4 |
|
Metano |
CH4 |
16,044 |
518,46 |
|
Neon |
Ne |
20,184 |
412,10 |
|
n-Butano |
C4H10 |
58,124 |
143,04 |
|
Ossido di azoto |
NO |
30,007 |
277,19 |
|
Ossido di carbonio |
CO |
28,012 |
296,93 |
|
Ossigeno |
O2 |
31,891 |
260,83 |
|
Propano |
C3H8 |
44,097 |
188,55 |
Tabella 1
Dalla tabella osserviamo che nella teoria dei gas perfetti l’aria viene considerata un sistema chimicamente omogeneo, ma in realtà non è cosi, poiché essa è una miscela composta al 25% di ossigeno (O2) e al 75% circa di azoto (N2), le quantità variano dall’altitudine e dalla presenza di sostanze inquinanti
Utilizzando di dati della tabella è possibile ricavare la costante R dell’aria
![]() (13)
(13)
Come abbiamo appena visto le grandezze che descrivono le proprietà dei gas sono il volume, la pressione e la temperatura . Per capire che relazione esiste tra di loro studiamo come si comporta un gas quando teniamo fissa una di queste grandezze e lasciamo variare il valore di un’altra. Osserviamo allora come varia il valore della terza grandezza.
Mantenendo costante la temperatura, il volume di una data massa di gas è inversamente proporzionale alla pressione.
Se con p si indica la pressione del gas e con V il suo volume, la legge di Boyle si esprime con la formula
![]() costante
(14)
costante
(14)
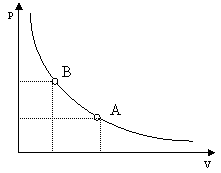
Figura 9 – Grafico rappresenta la legge di Boyle
in un diagramma pressione-volume
La curva del grafico (Fig. 9), che è un ramo di iperbole equilatera, visualizza la relazione di proporzionalità inversa tra la pressione e il volume. Passando dallo stato A allo stato B (o viceversa) il gas subisce una trasformazione isoterma (cioè a temperatura costante).
1° Legge di Gay-Lussac
Consideriamo
ora la trasformazione a pressione costante
(trasformazione isobara). Secondo la 1° Legge di Gay-Lussac il volume di una data massa di un gas è
direttamente proporzionale alla temperatura
![]() (15)
(15)
Dove V(t) e V0 sono i volumi che il gas occupa rispettivamente alla temperatura Celsius t e a 0°C e α è una costante caratteristica dei gas e ha il valore di 1/273,15 °C
Questa trasformazione può essere rappresentata in un grafico nel quale sull’asse orizzontale è riportata la temperatura e sull’asse verticale il volume (Fig. 10). La curva è una retta perché la variazione di volume è direttamente proporzionale alla variazione di temperatura.

Figura 10 – Grafico che rappresenta la prima legge di Gay-Lussac in un diagramma volume-temperatura
A volume costante la pressione è direttamente proporzionale alla temperatura ( le molecole colpiscono le pareti più frequentemente). Una trasformazione di questo tipo si chiama isocora, cioè trasformazione a volume costante.
La relazione tra la temperatura e la pressione è espressa dalla formula
![]() (16)
(16)
p e po sono rispettivamente le pressioni del gas alla temperatura Celsius t e a 0°C.

Figura 11 – Grafico che rappresenta la seconda legge di Gay-Lussac in diagramma pressione-volume
La trasformazione è rappresentata da una retta (Fig.11), ciò significa che la variazione di pressione è direttamente proporzionale alla variazione di temperatura.
Ricaviamo le caratteristiche termodinamiche dei gas perfetti
Il volume specifico si ricava facilmente sostituendo i valori di R, T e p nella (8)
![]() (17)
(17)
Dove R è uguale a Ro/m, T è la temperatura assoluta in Kelvin (K) e p è la pressione assoluta in Pascal (Pa).
Una delle caratteristiche del gas ideale è che
![]() (18)
(18)
dove u è l’energia interna del gas e
![]() (19)
(19)
dove h è l’entalpia.
u e h sono misure dello stato energetico e dipendono solo dalla temperatura, quindi sapendo t conosco u e h indipendentemente dalla pressione a cui il gas è sottoposto.
Ricordiamo che
![]() (20)
(20)
![]() (21)
(21)
Quindi per i gas ideali
![]() (22)
(22)
![]() (23)
(23)
dove cv è il calore specifico a volume costante e cp è il calore specifico a pressione costante.
Si constata che, per il gas perfetto, anche i calori specifici a pressione e a volume costante dipendono solo dalla temperatura, infatti nel caso di v = costante prendiamo un recipiente chiuso da cui non può fuoriuscire il gas (Fig. 12)

Figura 12 – Recipiente chiuso contenente gas
![]() (24)
(24)
dove Q è il calore fornito e ΔT è l’incremento della temperatura.
Nel caso della pressione costante prendo un recipiente provvisto di stantuffo che mantiene costante la pressione del gas (Fig.13)

Figura 13 – Recipiente con pistone contenente gas
![]() (25)
(25)
dove Q è il calore fornito e ΔT è l’incremento della temperatura.
Nel gas ideale è importante che h e u dipendano solo dalla temperatura.
Quindi nel caso del gas ideale le equazioni (24) e (25) rimangono costanti all’interno di uno stesso gas e si dimostra anche che
![]() (26)
(26)
Esiste un’ulteriore relazione che lega tra loro i calori specifici cv e cp e viene chiamato rapporto tra i
calori specifici γ
![]() (27)
(27)
γ vale
![]() per
i gas monoatomici
(28)
per
i gas monoatomici
(28)
![]() per i gas biatomici
(29)
per i gas biatomici
(29)
![]() per
i gas poliatomici
(30)
per
i gas poliatomici
(30)
Utilizzando le formule (26) e (27) si possono ricavare cv e cp risolvendo il sistema
 (31)
(31)
Alcuni valori di cv e cp sono riportati nella seguente tabella in cui sono contenuti i calori specifici medi impiegabili nell’intervallo 0÷100°C, al di fuori di questo intervallo diventano inaccurati
|
Sostanza |
Formula |
cp ( kJ/kg
K) |
cv (kJ/kg k) |
|
Acetilene |
C2H2 |
1,623 |
|
|
Acqua |
H2O |
0,444 |
|
|
Ammoniaca |
NH3 |
2,218 |
1,766 |
|
Anidride carbonica |
CO2 |
0,865 |
0,676 |
|
Anidride solforosa |
SO2 |
0,607 |
|
|
Aria |
|
1,01 |
0,717 |
|
Azoto |
N2 |
1,04 |
0,743 |
|
Etano |
C2H6 |
1,646 |
|
|
Etilene |
C2H4 |
1,460 |
|
|
Idrogeno |
H2 |
14,2 |
10,1 |
|
Metano |
CH4 |
2,165 |
1,645 |
|
Ossido di azoto |
NO |
0,999 |
|
|
Ossido di carbonio |
CO |
1,04 |
0,743 |
|
Ossigeno |
O2 |
0,917 |
0,656 |
|
Propano |
C3H8 |
1,550 |
|
Tabella 2
Trovati
quanto valgono cv
e cp
ricavo il valore di Δu e di Δh
![]() (32)
(32)
![]() (33)
(33)
Ad esempio posso notare che
![]() (34)
(34)
grazie a questa equazione assegnando una valore a u![]() e conoscendo ΔT,
che è uguale a T1 – T2, ricavo facilmente u
e conoscendo ΔT,
che è uguale a T1 – T2, ricavo facilmente u![]() .
.
Dalla definizione di entropia
![]() (35)
(35)
dove Δq è il calore scambiato dal sistema, Δu è la variazione di energia interna e Δv è la variazione di volume. Dall’equazione (35) ottengo che le espressioni per il gas ideale nel caso dell’entropia sono
 (36)
(36)
oppure
 (37)
(37)
Riprendendo il diagramma pressione-volume dei gas perfetti è possibile trovare, oltre alle isoterme, un’altra famiglia di curve, le adiabatiche ( trasformazioni in cui non vengono tenuti in considerazione gli scambi di calore ).

Figura 14 – Diagramma pressione-volume
La relazione che descrive questa curva è
![]() costante (38)
costante (38)
con γ descritta nell’equazione (27).
In una trasformazione adiabatica che avviene in modo irreversibile
![]() (39)
(39)
con Δq uguale a zero.
Quindi l’entropia nei gas perfetti rimane costante.
![]()
![]()
![]()
