MACCHINA FRIGORIFERA - MISCELE DI ARIA E VAPORE:
- Schema tecnologico della macchina frigorifera.
- Diagrammi P – H : 1) Freon R12
2) Ammoniaca
- Prestazioni termodinamiche: il rendimento h
- Fluidi refrigeranti: 1) Ammoniaca
2) Freons
- Danni ambientali dei CFC: 1) Buco nell’ozono
Miscele di aria e vapore :
- Unità di misura dell’umidità: 1) Titolo X
- Relazione tra grado idrometrico e Titolo X
- Calcolo dell’entalpia specifica di una miscela d’aria e vapore
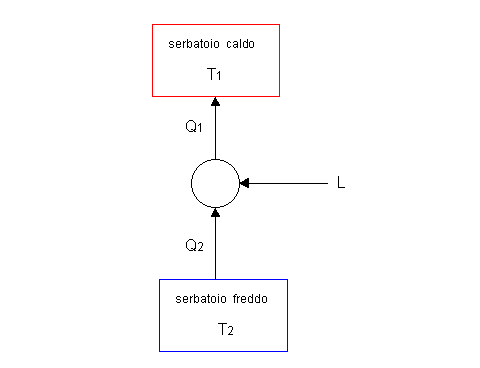
La macchina frigorifera è una macchina che riceve lavoro dall’esterno e calore da un certo ambiente, ed emette una quantità maggiore di calore.
La macchina frigorifera è una macchina che funziona nel senso contrario rispetto alla macchina a vapore:
*La macchina a vapore sfrutta l’energia termica di un vapore o di un gas e la trasforma in energia meccanica
*La macchina frigorifera sfrutta energia meccanica e rende possibile lo scambio di calore fra una sorgente fredda, a cui sottrae calore, e una sorgente calda, a cui cede calore.
Per questo motivo la macchina frigorifera viene anche chiamata macchina inversa. Essa funziona schematicamente in questo modo:

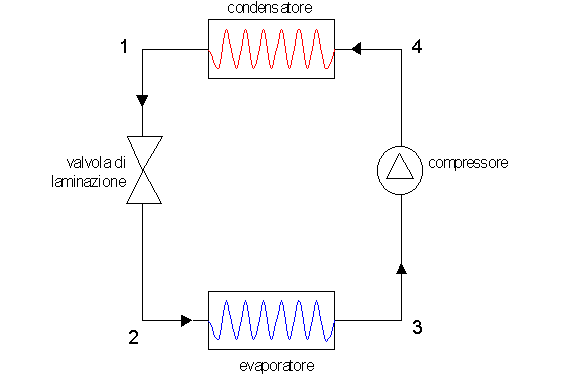
Il funzionamento della macchina frigorifera si basa su continue variazioni di pressioni e volume di una relativamente piccola massa costante di un liquido, detto “refrigerante”. Esso viene fatto passare, tramite un compressore, in un condensatore e successivamente, tramite una valvola di laminazione, in un evaporatore.
La macchina frigorifera è composta da 4 sistemi aperti, che collegati fra loro generano un sistema chiuso:
* Due batterie, all’interno delle quali avviene il cambiamento di stato del gas:
1) Evaporatore: + freddo; in esso avviene passaggio liquido > vapore
2) Condensatore: + caldo; in esso avviene il passaggio vapore > liquido
* Due meccanismi che mantengano forzatamente le due diverse temperature T1 e T2:
3) Compressore (pompa): mantiene una pressione elevata nel condensatore
4) Valvola di laminazione: regola l’espansione e quindi l’evaporazione del fluido
Come detto prima, la macchina frigorifera si definisce “inversa”: infatti percorre nel senso opposto il ciclo della macchina a vapore (diretta).
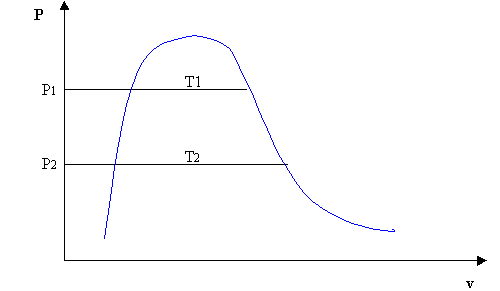
Il ciclo della macchina frigorifera si può facilmente rappresentare su un diagramma P-V:
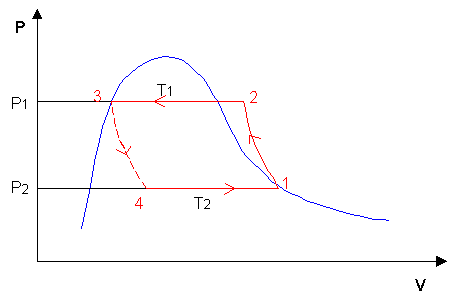
Si analizzano ora più in dettaglio le varie trasformazioni del ciclo:
1 > 2 Compressore (pompa)
Il fluido, che in 1 si trova allo stato di vapore saturo secco, passa attraverso il compressore, che ne aumenta la pressione attraverso una trasformazione adiabatica reversibile.
Durante questo passaggio si registra un aumento significativo della temperatura del fluido, che in 2 si trova nel campo del vapore surriscaldato. Il compressore, per esser mosso, necessita di un lavoro esterno (+Lc). Questo azionamento è effettuato nella maggior parte dei casi da motori elettrici. Questo lavoro si può esprimere come:
L= h2 – h1 >0
2 > 3 Condensatore
Il fluido percorre la serpentina del condensatore e, attraverso una trasformazione isobara, cede calore ( Q1) e comincia a raffreddarsi a pressione costante, fino a raggiungere lo stato di vapore saturo secco. Sempre a pressione costante, il vapore comincia a condensare e a tenperatura costante giunge in 3.
Q1 = h2 – h3
3 > 4 Valvola di laminazione
Il fluido entra nella valvola di laminazione e subisce una trasformazione isoentalpica (h1= h2) che ne diminuisce la pressione e la temperatura e ne aumenta il volume. La valvola rende questo processo irreversibile, e da ciò deriva la l’impossibilità di tracciare un percorso definito da 1 a 2. Altrettanto indefinita risulta essere l’area del ciclo frigorifero, e questo rappresenta uno svantaggio rilevante.
4 > 1 Evaporatore
Nell’evaporatore il fluido, che prima era allo stato liquido, diventa vapore attraverso una trasformazione isoterma e isobara, assorbendo il calore Q2 fornito al sistema, fino a raggiungere lo stato iniziale 1 dove può ricominciare il ciclo.
Q2 = h1 - h4
DIAGRAMMI P–H DEI FLUIDI REFRIGERANTI:
Le ditte produttrici, come ad esempio la Du Pont, vendono i loro prodotti chimici fornendone i dati caratteristici sotto forma di grafici pressione – entalpia (P – H).
Naturalmente questi grafici sono diversi a seconda del fluido: ogni fluido ha infatti delle proprie curve limite.
Da questi grafici si possono ricavare i valori dell’entalpia corrispondenti a determinate pressioni e temperature.
Le prestazioni termodinamiche di una macchina frigorifera si misurano con il rapporto:
![]()
A seconda dell’uso della mia macchina frigorifera, si hanno due rendimenti h, che valutano le prestazioni termodinamiche della macchina:
1) La macchina viene usata per raffreddare il serbatoio a temperatura inferiore:
![]()

Poiché abbiam considerato il ciclo frigorifero come una successione di sistemi aperti, si trova che:
2) La macchina viene usata per prelevare calore da un serbatoio freddo e cedendone una quantità maggiore
(riscaldando dunque) ad un serbatoio caldo:
![]()
Da questa si ha che:
![]()
In questo caso la macchina viene chiamata “pompa di calore”.
Che vantaggi si hanno ad usare una macchina frigorifera per riscaldare? Ottengo una quantità di calore Q1 molto maggiore del lavoro che spendo per ottenerlo. La pompa di calore funziona quindi da “moltiplicatore di energia”.
E’ molto costosa e per questo la si utilizza solo nel caso essa sia già prevista per uso estivo, per esempio nel caso di grandi edifici pubblici. In questo caso l’impianto verrà usato in estate per rinfrescare, e in inverno per riscaldare, con un notevole risparmio energetico.
Nel caso di grandi edifici è d’obbligo fornire il ricambio di 2 volumi orari d’aria ad ogni ambiente (Per esempio, se il mio ambiente è di 200m3, devo dare 400m3 di aria all’ora).
E’ compito del progettista dare le informazioni sul dimensionamento della macchina frigorifera necessaria.
Purtroppo molto spesso sono invece le imprese ad occuparsene. Esse, per avere maggiori profitti di vendita, installano spesso macchine sovradimensionate che prevedono un maggior costo d’acquisto e di gestione: infatti la macchina lavora solo al 20% della sua possibilità.
Le macchine frigorifere funzionano utilizzando vapore saturo. Il fluido utilizzato è in stati fisici sotto la curva limite superiore ed è chiamato refrigerante.
Vengon definiti refrigeranti i fluidi utilizzati negli impianti frigoriferi e a pompa di calore.
Un fluido refrigerante deve avere particolari caratteristiche:
1) Non deve esser pericoloso per le persone;
2) Non deve esser dannoso per l’ambiente;
3) Non deve aggredire chimicamente gli altri componenti del ciclo;
4) Deve poter mantenere all’interno del suo campo di lavoro, una pressione maggiore di quella atmosferica, al fine di impedire entrate di aria umida nell’impianto;
5) Deve presentare nelle normali condizioni operative, un rapporto non troppo elevato tra le pressioni di condensazione ed evaporazione, per minor consumo di energie per la compressione;
6) Deve avere, alla temperatura di evaporazione, un valore particolarmente elevato di calore latente di cambiamento di fase, e allo stesso tempo un valore del volume specifico, per diminuire la portata volumetrica per unità di flusso termico asportato.
Purtroppo l’acqua non è adatta per funzionare come liquido refrigerante. Infatti:
- Non può scendere a valori inferiori di 0°C (a 0° l’acqua solidifica)
- Evapora a temperature troppo alte rispetto a quelle d’altri gas
- Presenta un dislivello troppo grande tra T1 e T2
La macchina frigorifera lavora invece con una differenza di temperatura di 20-30°C e spesso la temperatura minima è di qualche grado sotto 0°C.
Quali sono dunque le sostanze che vengono usate come liquidi refrigeranti?
Le più usate sono l’ammoniaca e i freons.
Ha il pregio dell’economicità, ma ha grossi difetti:
1) è irritante per le vie respiratorie
2) è esplosiva se mescolata con piccole quantità di acqua
L’ammoniaca è molto usata per grandi impianti; per i piccoli impianti viene usata solo se la macchina frigorifera è esterna alla casa.
In questo tipo di macchina frigorifera, l’ammoniaca viene utilizzata per creare acqua calda e fredda, che vien poi fatta scorrere, tramite tubi, nell’ambiente.
Lo svantaggio è che nel passaggio di temperatura dall’ammoniaca all’acqua parte dell’energia viene dissipata, cioè si ottiene un rendimento minore.
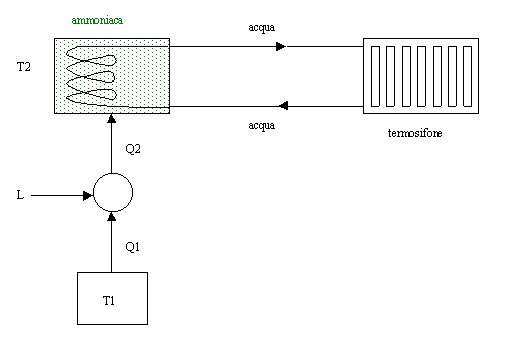
La soluzione migliore sarebbe dunque trasportare direttamente l’ammoniaca: si otterrebbe un’energia maggiore con una minore portata di fluido. Ma la pericolosità ambientale dell’ammoniaca ci porta a scartare questa possibilità.
Sono della famiglia chimica dei cluoro-fluoro carburi (composti organici ai quali sono stati aggiunti atomi di Cl e F).
Il capostipite di questa famiglia è il Freon, registrato dalla Du Pont come F12. A partire da questo composto le industrie chimiche hanno iniziato a sbizzarrirsi in nuovi composti.
Come l’ammoniaca, anche i freons sono pericolosi, ma rispetto all’ammoniaca:
- Hanno una maggiore inerzia chimica
- Non brucia, né scoppia
- Non irrita le vie respiratorie
Porta però ad altri problemi :mentre l’ammoniaca a causa della sua reattività si consuma, i freons, proprio per la loro stabilità chimica, sono indistruttibili.
Il freon viene rilasciato prevalentemente da:
1) macchine frigorifere difettose
2) piccole macchine frigorifere in rottamazione (quando si rottamano le grosse macchine, il freon viene recuperato e riutilizzato; per le piccole macchine costerebbe più l’operazione di recupero del freon recuperato)
3) bombolette spray con il freon
I principali danni ambientali causati dal freon sono:
- il buco dell’ozono
- l’effetto serra
La Terra è circondata da uno strato di ozono, che ha la funzione di ridurre l’intensità delle radiazioni ultraviolette del Sole che arrivano sulla Terra.
L’ozono è un composto che ha formula O3, cioè è formato da tre atomi di ossigeno.
Esso si forma dall’ossigeno molecolare a seguito di assorbimento di energia sotto forma di radiazioni ultraviolette:
3O2 + energia < > 2O3
Grazie a questa reazione dunque il raggio solare giunge a noi depotenziato.
Il freon rende difficoltosa questa reazione. Quando viene liberato nell’aria, raggiunge uno strato ricco d’ozono e ne fa diminuire la concentrazione. In questo modo diminuisce la capacità di assorbimento delle nocive radiazioni solari ultraviolette da parte dell’ozonosfera (lo strato di ozono); queste radiazioni, arrivando in maggior quantità sulla superficie terrestre, posson causare gravi danni all’uomo (disturbi agli occhi, eritemi, cancro della pelle) e soprattutto agli animali inferiori (distruzione irreversibile dei tessuti, fino al decesso) e alle piante (inibizione parziale della fotosintesi, con riduzione della crescita e quindi minor produzione delle messi).
Il problema della riduzione dello strato d’ozono che circonda il nostro pianeta si è imposto all’attenzione della comunità scientifica e ha avuto grande risonanza anche nei mezzi di comunicazione di massa soltanto in tempi recenti, quando intorno agli anni ’80 un gruppo di ricercatori operanti in Antartide rese noto che nell’arco di soli 8 anni la concentrazione di ozono nell’aria che sovrasta il Polo sud era diminuita di circa il 40%; vennero allora programmate nuove indagini per studiare il fenomeno, per il quale si cominciò a parlare comunemente di “buco dell’ozono”.
Dalle ricerche fatte si sono costatate sensibili variazioni della quantità di ozono, al Polo sud, negli anni e anche con le varie stagioni. Si sono dunque interpretate queste variazioni come semplici fluttuazioni naturali, destinate a manifestarsi periodicamente. I CFC sembra che abbiano l’effetto di accelerare questo fenomeno della ricorrente diminuzione dell’ozono.
L’allarme lanciato da molti scienziati ha indotto molti paesi ad avviare iniziative per evitare la progressiva e drastica riduzione dell’ozono stratosferico. Dopo varie riunioni di ricercatori e dirigenti politici mondiali, è stato deciso di diminuire drasticamente la produzione delle sostanze nocive responsabili della distruzione dell’ozono. In particolare si è arrivati a proibire la produzione dei CFC dal 1995. Va sottolineato però che al posto dei CFC verranno usati, fino al 2030, altri gas loro derivati: gli idrocluorofluorocarburi (HCFC) e idrofluorocarburi (HFC); essi, anche se non danneggiano l’ozonosfera altrettanto gravemente dei CFC, sono altrettanto pericolosi in quanto sono gas serra potenti quasi come i CFC.
E’ un fenomeno legato all’irraggiamento termico.
L’energia solare ci giunge sottoforma di radiazioni, ossia di onde elettromagnetiche, con lunghezza d’onda l relativamente piccole, comprese tra 0.17 e 4 m , che in Meteorologia vengono considerate come “onde corte”. La Terra riceve dunque energia dal Sole, la assorbe e la converte in calore e, di conseguenza, emette anch’essa energia, sotto forma di radiazioni aventi lunghezza d’onda l comprese all’incirca fra 4 e 80 m , che vengon considerate come onde lunghe.
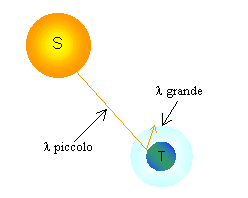 In
sostanza il sistema Terra- atmosfera guadagna e perde energia: il divario fra la
radiazione solare che entra e la radiazione terrestre che esce forma il bilancio
termico (radiativo) del nostro pianeta.
In
sostanza il sistema Terra- atmosfera guadagna e perde energia: il divario fra la
radiazione solare che entra e la radiazione terrestre che esce forma il bilancio
termico (radiativo) del nostro pianeta.
Soltanto il 51% della radiazione solare riesce ad arrivare fino alla superficie terrestre, dopo aver attraversato l’involucro aeriforme: parte dell’energia infatti viene riflessa direttamente nello spazio e parte viene assorbita direttamente dall’atmosfera. A questo 51% bisognerà sottrarre un 4% circa, a causa della riflessione media dovuta al globo terraqueo, per ottenere la radiazione effettiva, che risulta così essere del 47%. Quest’ultima parte si trasforma in energia sotto forma di radiazioni ad onde lunghe.
Nel complesso il rapporto fra la quantità di energia che viene riflessa immediatamente nello spazio e l’energia totale in arrivo del sistema “Terra – atmosfera” si può valutare intorno al 35%.
Da quanto sopra detto si può dunque desumere che il sistema “Terra – atmosfera” dispone soltanto del 65% della solare incidente e che la quantità assorbita (e riemessa) dalla superficie terrestre è molto maggiore di quella assorbita dall’atmosfera. Di conseguenza, gran parte del calore atmosferico deve derivare indirettamente dalla superficie terrestre, la quale funziona come una piastra, riscaldando l’aria dal di sotto.
L’atmosfera, dunque, si comporta come i vetri di una serra: come questi, essa lascia passare senza perdite sensibili le radiazioni solari, ma intercetta le radiazioni termiche terrestri e così si può mantenere calda. Il bilancio energetico della Terra si sposta così ad una temperatura più elevata con conseguente surriscaldamento del pianeta. Tale comportamento dovuto principalmente alla presenza di vapor acqueo e dell’anidride carbonica, è noto fin dalla fine del secolo scorso e viene indicato come “effetto serra”.
Di esso si sta discutendo molto in questi anni poiché sembra che il suo meccanismo si stia intensificando per cause antropiche: tutti i gas inquinanti infatti (anidride carbonica, metano, carbon fossile, anidridi solforose, etc.) sembrano aumentare la selettività dell’atmosfera, cosicché la temperatura superficiale della Terra sia attualmente di circa 35°C superiore a quella che si avrebbe in loro assenza.
Questi cicli di cambiamento dell’atmosfera si sono verificati spesso ciclicamente, per esempio per l’intensa attività vulcanica alla nascita del pianeta, o per la nascita dei primi organismi aerobi (che l’ hanno totalmente modificata). Sono dunque fenomeni naturali, solo che ora l’uomo li sta notevolmente accelerando. Qualche studioso ipotizza che, osservando cambiamenti ciclici con glaciazione della Terra si hanno ogni 20.000 – 30.000 anni, essa si riscalderà fino ad un punto massimo e che tra altri 10.000 anni si arriverà ad un’altra glaciazione.
Studiando le miscele di acqua e vapore, considereremo l’aria come un solo componente, perché la composizione dell’aria sarà assunta costante.
L’acqua potrà essere in parte liquida e in parte in forma d vapore.
La fase gassosa della miscela sarà considerata una miscela di due gas ideali: aria e vapore acqueo. In quanto tali, aria e il vapore acqueo non si influenzano vicendevolmente.
La composizione della fase gassosa potrà variare, per effetto di evaporazione o condensazione di acqua. Quindi la massa di aria secca viene considerata costante, mentre la massa di vapore cambia facilmente. Questo è il motivo per il quale le grandezze specifiche non vengono riferite all’unità di massa della miscela, ma all’unità di massa dell’aria secca.
Consideriamo il seguente esperimento: in presenza di aria inizialmente secca poniamo in un ambiente chiuso un recipiente contenente acqua, mantenendo P e T costanti.
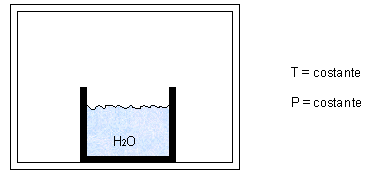
Dopo un certo periodo di tempo si vede che il livello dell’acqua nel contenitore è calato, cioè una certa massa di acqua è evaporata nell’aria. Il livello continuerà a calare sempre più lentamente fino a rimanere costante.
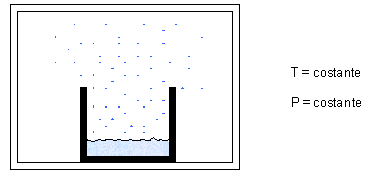
L’acqua evapora infatti solo fino a un certo punto: fino a che la pressione parziale del vapore saturo eguaglia la pressione di saturazione dell’acqua alla temperatura T alla quale si opera.
La quantità fisica di acqua che evapora è sempre la stessa indipendentemente dall’aria (come tutti i gas perfetti).
Quando l’acqua non evapora più si parla di saturazione e dunque anche di pressione di saturazione Pvs.
All’interno di un’abitazione, normalmente non c’è mai una quantità di vapore acqueo sufficiente per raggiungere la saturazione.
In particolare: Mv < Mvs dove: - Mv = massa del vapore presente
- Mvs = massa del vapore di saturazione
UNITA’ DI MISURA DELL’UMIDITA’: X, UR, w
Esso è definito come:
![]()

Attenzione a non confondere il Titolo X con il Titolo dei vapori saturi, che corrisponde al rapporto tra la massa del vapore e la massa del sistema. A differenza del Titolo dei vapori saturi, il Titolo X non è un numero puro e non è necessariamente minore di 1.
La grandezza che esprime qual è la massima massa di acqua che può volatilizzarsi in una massa di aria secca è il titolo di saturazione XS, cioè il titolo calcolato in condizioni di equilibrio tra aria e acqua in presenza di acqua liquida.
Il titolo di saturazione XS è dipendente da pressione e temperatura.
Solitamente si lavora in un sistema isobaro, a pressione atmosferica pA=1.013 bar, quindi il titolo di saturazione viene a dipendere solo dalla temperatura.
I valori del titolo di saturazione riferiti alla pressione atmosferica in funzione della temperatura sono reperibili su apposite tabelle: nella seguente sono riportati alcuni valori assunti dai parametri T, P e Xs della miscela aria-vapore d’acqua per φ=1 e p=101,3 kPa:
|
Temperatura dell’aria T |
Pressione di vapore dell’aria satura PS |
Titolo di saturazione XS |
|
°C |
mmHg
mbar |
gv/Kga |
|
-20 |
0,756
0,102 |
0,63 |
|
-19 |
0,848
0,113 |
0,7 |
|
-18 |
0,938
0,125 |
0,77 |
|
-17 |
1,028
0,137 |
0,85 |
|
-16 |
1,125
0,150 |
0,93 |
|
-15 |
1,238
0,165 |
1,01 |
|
-14 |
1,358
0,181 |
1,11 |
|
-13 |
1,485
0,198 |
1,22 |
|
-12 |
1,628
0,217 |
1,34 |
|
-11 |
1,778
0,237 |
1,46 |
|
-10 |
1,943
0,259 |
1,6 |
|
-9 |
2,123
0,283 |
1,75 |
|
-8 |
2,318
0,309 |
1,91 |
|
-7 |
2,520
0,336 |
2,08 |
|
-6 |
2,753
0,367 |
2,27 |
|
-5 |
3,01
0,400 |
2,49 |
|
-4 |
3,270
0,436 |
2,69 |
|
-3 |
3,563
0,475 |
2,94 |
|
-2 |
3,870
0,516 |
3,19 |
|
-1 |
4,208
0,561 |
3,47 |
|
0 |
4,568
0,609 |
3,78 |
|
1 |
4,920
0,656 |
4,07 |
|
2 |
5,280
0,704 |
4,37 |
|
3 |
5,678
0,757 |
4,7 |
|
4 |
6,083
0,811 |
5,03 |
|
5 |
6,526
0,870 |
5,4 |
|
6 |
6,991
0,932 |
5,79 |
|
7 |
7,493
0,999 |
6,21 |
|
8 |
8,026
1,070 |
6,65 |
|
9 |
8,596
1,146 |
7,13 |
|
10 |
9,188
1,225 |
7,63 |
|
11 |
9,818
1,309 |
8,15 |
|
12 |
10,493
1,399 |
8,75 |
|
13 |
11,206
1,595 |
9,35 |
|
14 |
11,963
1,595 |
9,97 |
|
15 |
12,759
1,701 |
10,6 |
|
16 |
13,599
1,813 |
11,4 |
|
17 |
14,491
1,932 |
12,2 |
|
18 |
15,444
2,059 |
12,9 |
|
19 |
16,441
2,192 |
13,8 |
|
20 |
17,484
2,331 |
14,7 |
|
21 |
18,602
2,480 |
15,6 |
|
22 |
19,779
2,637 |
16,6 |
|
23 |
21,017
2,802 |
17,7 |
|
24 |
22,300
2,977 |
18,8 |
|
25 |
23,702
3,160 |
20 |
|
26 |
25,150
3,353 |
21,4 |
|
27 |
26,672
3,556 |
22,6 |
|
28 |
28,285
3,771 |
24 |
|
29 |
29,965
3,995 |
25,6 |
|
30 |
31,784
4,232 |
27,2 |
|
31 |
33,618
4,482 |
28,8 |
|
32 |
35,575
4,746 |
30,6 |
|
33 |
37,638
5,018 |
32,5 |
|
34 |
39,806
5,307 |
34,4 |
|
35 |
42,078
5,610 |
36,6 |
|
36 |
44,449
5,926 |
38,8 |
|
37 |
46,954
6,260 |
41,1 |
|
38 |
49,572
6,609 |
43,5 |
|
39 |
51,317
6,975 |
46 |
|
40 |
55,198
7,358 |
48,8 |
|
41 |
58,197
7,759 |
51,7 |
|
42 |
61,355
8,180 |
54,8 |
|
43 |
64,640
8,618 |
58 |
|
44 |
68,098
9,079 |
61,3 |
|
45 |
71,706
9,560 |
65 |
|
46 |
75,464
10,061 |
68,9 |
|
47 |
79,409
10,587 |
72,8 |
|
48 |
83,504
11,133 |
77 |
|
49 |
87,810
11,707 |
81,5 |
|
50 |
92,288
12,304 |
86,2 |
|
55 |
117,715
15,094 |
114 |
|
60 |
149,037
19,870 |
152 |
|
65 |
187,050
24,938 |
204 |
|
70 |
233,134
31,082 |
276 |
|
75 |
288,398
38,450 |
382 |
|
80 |
354,239
47,228 |
545 |
|
85 |
432,553
57,669 |
828 |
|
90 |
524,525
69,931 |
1400 |
|
95 |
625,618
83,409 |
3120 |
|
100 |
759,812
101,300 |
- |
Altre unità di misura dell’umidità sono:
![]()

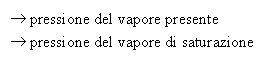
Dalla legge che afferma la proporzionalità tra masse e pressioni, si ricava:
![]()
Il concetto fisico di questi due valori è lo stesso: i due valori mi indicano quanto l’aria sia effettivamente prossima alla saturazione.
La differenza tra le due unità è che l’umidità relativa è espressa in percentuali mentre il grado igrometrico è espresso con un numero compreso tra 0 e 1. ( Es. Se UR = 40% > w = 0.4)
Si ricorda che normalmente in un ambiente non si raggiunge mai la saturazione; il valore di UR dunque sarà sempre <1.
La definizione di umidità relativa UR si correla molto bene con la nostra sensazione di umidità ma non con il calcolo termico: la pressione di saturazione infatti varia con la temperatura. Per questo spesso si preferisce usare il Titolo X
RELAZIONE TRA GRADO IGROMETRICO E TITOLO X
Per le ipotesi precedentemente fatte, è lecito considerare le miscele di aria e vapore acqueo come due gas ideali; possiamo quindi scrivere l’equazioni di stato dei gas perfetti prima per l’aria e poi per il vapore acqueo:
![]()
![]()
Da queste, partendo dalla definizione di Titolo X:
![]()
Dato che:
![]()
![]()
Segue che:
![]()
Per cui:
![]()
Dato che:
![]()
2) PA + PV = Ptot (Pressione atmosferica) > PA=Ptot-PV
Sostituendo i valori trovati di PA e PV nell’equazione che definisce il Titolo X:
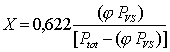
> X (Ptot - w PVS) = 0,622 w PVS
> w PVS ( 0,622 + X) = X Ptot
Esplicitando w si conclude che:
![]()
Questa equazione consente di passare dal grado idrometrico al titolo e viceversa.
La pressione di saturazione PVS di un determinato vapore può assumere diversi valori in base alla temperatura. Esso si può facilmente trovare nelle apposite tabelle del vapor saturo.
Sono gli architetti, in qualità di progettisti, a dovere imporre determinate condizioni termoidrometriche per un ambiente, cioè determinati valori di TP (temperatura di progetto) e UR (umidità relativa).
Queste due quantità sono interdipendenti: esistono delle curve di iso-comfort, lungo le quali posso avere le stesse condizioni di confort con T1 minore e UR 1 maggiore oppure con T2 maggiore e UR 2 minore.
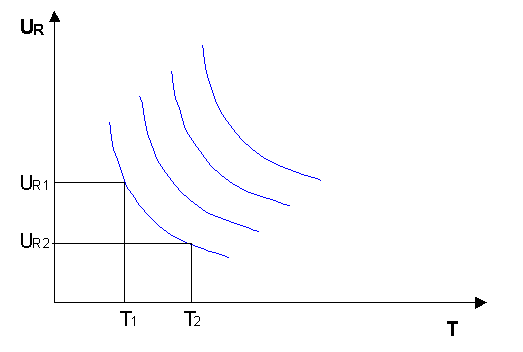
La scelta della curva di Iso-Confort varia in base a:
1) Destinazione d’uso dell’ambiente > attività fisica delle persone [MET].
Il
MET è un’unità metabolica: Un MET è uguale al metabolismo base di una
persona ![]() 200 W.
200 W.
2) Quanto le persone sono vestite [CLO].
Il CLO è un’unità che misura la resistenza termica tipica di una persona vestita “normalmente” (pantaloni, giacca, camicia a maniche lunghe).
Lo studio delle curve di iso-confort è stato introdotto per motivi pratici: si è dimostrato che mantenendo determinate condizioni di T e UR sul posto di lavoro, è possibile aumentare la produttività.
Le curve di iso-confort presentano dei limiti: solo in certi intervalli infatti è valido l’interscambio tra UR e T.
CALCOLO DELL’ENTALPIA DI UNA MISCELA DI ACQUA E VAPORE
Premessa: tutte le grandezze specifiche sono riferite all’unità di massa di aria secca e non all’unità di massa della miscela: quest’ultima infatti può variare a seconda della quantità di vapore che condensa o evapora.
L’entalpia specifica riferita all’unità di massa di aria secca J è definita come:Esso è definito come:

Essendo H = MA hA + Mv hv
dove: - hA è l’ entalpia dell’aria secca
- hv è l’ entalpia del vapore
Si può scrivere l’entalpia come:
![]()
Essendo: - hA = cPA t
- hv = r0 + cPV t
J = cPA t + X (r0 + cPV t)
Essendo: - cPA = calore specifico dell’aria = 1 KJ/Kg
- cPV = calore specifico del vapore acqueo » 1,9 KJ/Kg
- r0 = calore latente di vaporizzazione dell’acqua a 0°C » 2500 KJ/Kg
- t = temperatura, espressa in gradi Celsius
Si ottiene:
J = 1t + X (2500 + 1,9t)
che risulta essere il bilancio energetico del sistema.
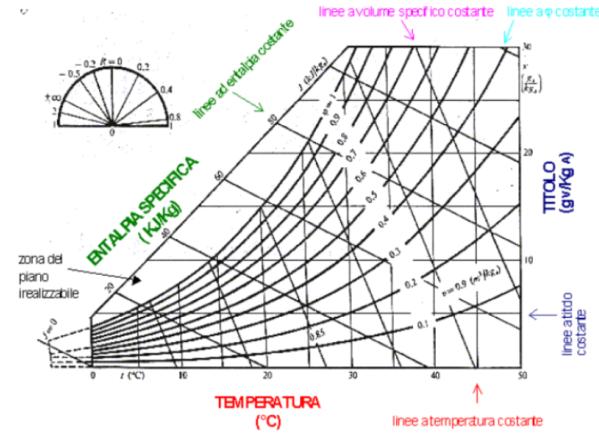
Sul diagramma psicometrico è possibile individuare gli stati di equilibrio delle miscele d’aria e acqua.
Su tale diagramma sono indicati tre assi, sui quali si posson leggere dati diversi:
1) asse verticale sul margine destro: titolo
2) asse orizzontale: temperatura
3) asse diagonale sul margine sinistro: entalpia specifica
Sul diagramma sono tracciate diverse curve:
1) rette verticali: rette a temperatura costante
2) rette orizzontali: rette a titolo costante
3) rette perpendicolari all’asse obliquo: rette a entalpia specifica
4) curva che delimita superiormente il diagramma: è detta curva di saturazione e rappresenta punti aventi grado idrometrico uguale a 1. Le curve dello stesso tipo tracciate sul diagramma sono curve a titolo costante.
5) rette oblique: rette di volume specifico costante