Monica Pisanu, Matricola n° 135103 03/11/00 h. 8.30-10.30
CAMBIAMENTI DI STATO
Ci sono due stati
termodinamici in cui si possono studiare i cambiamenti di stato: il sistema
chimicamente puro (es. H2O) ed il sistema mescolato, non
chimicamente puro (es. H2O+O2+N2). Noi ci
occuperemo di sistemi chimicamente puri, poiché i sistemi mescolati sono più
complessi.
Esempio
Studio del cambiamento di
stato di un cubetto di ghiaccio che, scaldato, passa dallo stato solido a
quello liquido e, quindi, allo stato di vapore.
- Temperatura interna del cubetto di
ghiaccio: -40° C
-
Massa
del cubetto di ghiaccio: 1 kg
-
Pressione:
1 bar
-
Calore
fornito: 1 kw
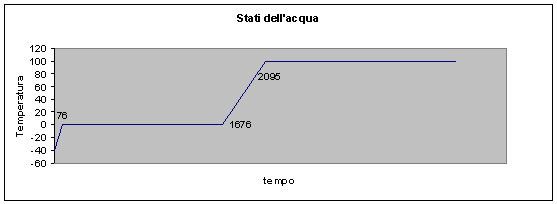
Inizialmente la temperatura cresce linearmente;
questo è dovuto al calore specifico dell’acqua a pressione costante (cp).
cp= ΔQ = Q 1 secondo = 1900
j
ΔT ΔT kg K
ΔT = Q 1 secondo = 1000 = 0,52° C/s
cp 1900
Finché l’acqua non si è
sciolta la temperatura rimane costante a 0° C, muovendosi nel nostro grafico
parallelamente all’asse della temperatura. Il tempo di scongelamento dipende
dal calore latente di fusione (rf).
rf = 1600000 j/kg
Δtf = rf = 1600000 =
1600 s
Q 1000
Il tempo occorso nel
passaggio del ghiaccio da solido a liquido, è maggiore in quanto la quantità in
gioco è maggiore.
Successivamente la
temperatura torna a salire ma la linea del grafico ha pendenza diversa da
quella assunta inizialmente, perché è cambiato il valore del calore specifico
dell’acqua; ora, infatti, non c’è più il calore specifico del ghiaccio ma del
liquido.
cp=
4187 j/kg K
ΔT =
1000 = 0,239° C/s
4187
Il valore della variazione
di temperatura, giustifica la pendenza meno ripida della linea del grafico.
Il passaggio dell’acqua
dallo stato liquido al vapore si svolge a temperatura costante, perché ciò
avvenga bisogna fornire calore latente di vaporizzazione (rV).
rV = 2257000 j/kg
Δt = rv = 2257000 = 2257 s
Q 1000
Facendo riscaldare il vapore, la linea del grafico
riprende nuovamente a salire con una pendenza più ripida della precedente, come
conseguenza del calore specifico del vapore (cpv).
cpv
= 1900 j/kg K
ΔT = Q = 0,52° C/s
cpv
Dopo quest’ultimo non si hanno più cambiamenti di
stato.
Com’è successo per le
molecole di acqua, succede per altri sistemi chimicamente puri, come ad esempio
l’anidride carbonica (CO2) e il metano (CH4).
CAMBIAMENTI DI
STATO A PRESSIONE NON COSTANTE
Cambiando la pressione la
sequenza delle trasformazioni di fase è la stessa ma, esse avvengono in modo
diverso. Aumentando la pressione la temperatura dello stato solido-liquido si abbassa mentre la temperatura
liquido-gas si alza (ad esempio H2O). Poiché ad ogni valore della
pressione diversa il diagramma si deforma è possibile indicare i fenomeni
utilizzando un volume tridimensionale.
Definito un sistema
tridimensionale di assi cartesiani ortogonali, su ognuno dei quali vengono
riportati i valori di una delle tre grandezze suddette, ad ogni terna di valori
p, v e T corrisponde un punto nella rappresentazione grafica: unendo
tutti i punti si ottiene, per ogni sostanza chimicamente pura, una superficie,
ad ogni punto della quale corrisponde uno ed un solo stato fisico di equilibrio
del sistema.
Sulla superficie (p, v
e T) si distinguono tre regioni S, L e G che contraddistinguono,
rispettivamente, lo stato solido, liquido e gassoso. Oltre a queste regioni ne
esistono altre di transizione caratterizzate dalla compresenza di due fasi di
equilibrio. All’interno di queste regioni la pressione e la temperatura sono
dipendenti tra loro, per cui lo stato fisico del sistema è definito solo dalle
coppie pressione-volume specifico o temperatura-volume specifico.
Nel grafico sono presenti
solo gli stati fisici stabili, quelli al di fuori di esso sono instabili.
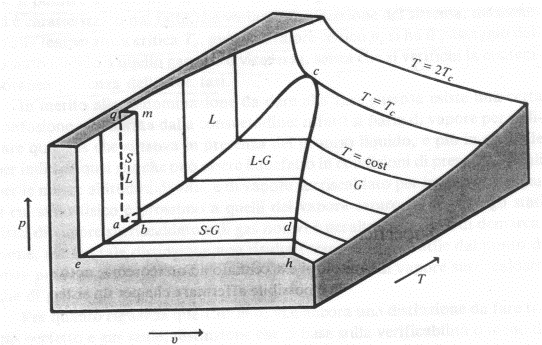
Superficie (p, v, T) per una sostanza che, solidificando, aumenta di volume.
DIAGRAMMA
TERMODINAMICO (p-v)
Si possono considerare,
anziché tutte e tre le variabili termodinamiche, due di queste ottenendo così
una rappresentazione bidimensionale. Consideriamo perciò il sistema di
riferimento (p, v) solo al di sopra degli 0° C, trascurando la fase solido-liquida,
per evitare di creare confusione nella rappresentazione.
Sul diagramma vengono
riportate le isoterme al di sopra degli 0°, che pur essendo caratterizzate da
temperature diverse, hanno nel grafico andamento similare.
Laddove nel grafico
temperatura e pressione sono bloccate ai valori rispettivamente di 0,01°C e di
0’006112 bar si colloca il punto triplo; in quest’ultimo i 3 stati fisici
coesistono.
L’ultimo valore che andiamo a studiare consiste nel punto critico. In questo punto si incontrano la curva limite inferiore e quella superiore.
La curva limite inferiore corrisponde, nella Figura
appartenente al riferimento (p, v, T), alla linea ac luogo dei punti rappresentanti gli stati fisici di equilibrio in
cui, pur potendo coesistere la fase liquida e gassosa, è presente la sola fase
liquida.
La curva limite superiore
coincide, invece, con la linea cd,
luogo dei punti rappresentativi di stati fisici di equilibrio in cui, pur
potendo coesistere le fasi liquida e gassosa, è presente la sola fase gassosa.
Perciò nel punto critico, giunti al valore della pressione critica (pc) e mantenendo costante la temperatura
critica (Tc), si ha il passaggio
dallo stato liquido a quello gassoso o viceversa, senza che le due fasi si
presentino contemporanenamente.
L’isoterma che passa per il
punto critico viene detta isoterma critica e presenta proprio in questo punto
un flesso, cioè un cambiamento di pendenza.
Oltre il punto critico le
isoterme si comportano come i gas perfetti, cioè vale
pv= RT dove pv=
costante
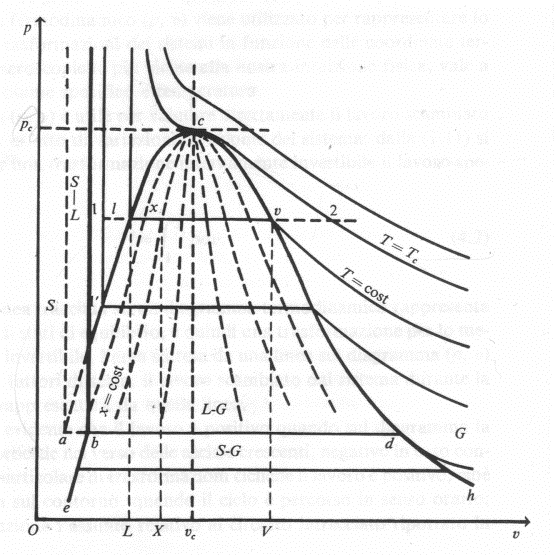
Diagramma termodinamico (p, v) per
una sostanza che, solidificando, aumenta di volume.
|
Temp. (°C) t |
Pressione Mpa p |
Volume spec. (m3/kg) vd
Vv |
Energia interna Spec. (kJ/kg) vl uv |
Entalpia spec. (kJ/kg) r hv |
Entropia spec. (kJ/kg K) sl sv |
||||
|
0,01 |
6,11x10-4 |
206,2 |
206,2 |
zero |
2.375,6 |
2.501,6 |
2.501,6 |
zero |
9,157 |
|
20 |
2,34x10-3 |
57,8 |
57,8 |
83,9 |
2.403,0 |
2.454,3 |
2.538,2 |
0,296 |
8,668 |
|
40 |
7,38x10-3 |
19,6 |
19,6 |
167,4 |
2.430,2 |
2.406,9 |
2.574,4 |
0,572 |
8.258 |
|
60,1 |
0,02 |
7,65 |
7,65 |
251,4 |
2.456,9 |
2.358,4 |
2.609,9 |
0,832 |
7,909 |
|
81,3 |
0,05 |
3,24 |
3,24 |
340,5 |
2.484,0 |
2.305,4 |
2.646,0 |
1,091 |
7,595 |
|
100 |
0,1013225 |
1,672 |
1,673 |
419,0 |
2.506,5 |
2.256,9 |
2.676,0 |
1,307 |
7,355 |
|
151,8 |
0,50 |
0,374 |
0,375 |
639,6 |
2.560,2 |
2.107,4 |
2.747,5 |
1,860 |
6,819 |
|
201,4 |
1,60 |
0,1225 |
0,1237 |
856,7 |
2.593,8 |
1.933,2 |
2.791,7 |
2,344 |
6,418 |
|
250,3 |
4,00 |
0,0485 |
0,0497 |
1.082,4 |
2.601,3 |
1.712,9 |
2.800,3 |
2,797 |
6,069 |
|
300,1 |
8,60 |
0,0202 |
0,0216 |
1.333,3 |
2.564,9 |
1.404,5 |
2.750,9 |
3,256 |
5,708 |
|
349,8 |
16,50 |
0,00709 |
0,00883 |
1.641,8 |
2.423,1 |
898,3 |
2.568,8 |
3,778 |
5,220 |
|
374,15 |
22,12 |
zero |
0,00317 |
2.308 |
2.308 |
zero |
2.108 |
4,444 |
4,444 |
Tabella – Caratteristiche di stato e termiche del vapore d’acqua saturo (dal punto triplo al punto critico).