Entropia
Partendo dallí uguaglianza di Clausius, ricavata in precedenza:
|
(1) |
![]()
è possibile definire una nuova variabile di stato.
Si consideri un sistema termodinamico in cui si passa da uno stato 1 ad uno stato 2 attraverso tre diverse trasformazioni reversibili (fig. 1):
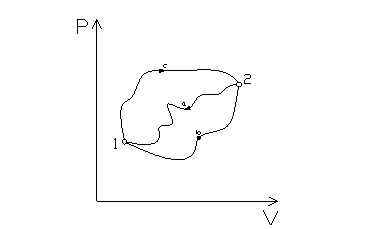
Fig.1
Grazie a (1) è possibile scrivere:
|
(2) |
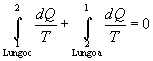
e, analogamente:
|
(3) |
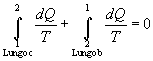
Sottraendo (3) a (2) si ottiene:
|
(4) |
Per lí arbitrarietà dei percorsi a e b si può ammettere la validità di questa uguaglianza per ogni coppia generica di percorsi reversibili dallo stato 2 allo stato 1.
Si deduce quindi che lí espressione:
|
(5) |
![]()
non dipende dal percorso seguito, ma dipende solo dagli estremi di integrazione, cioè dal punto di partenza e dal punto di arrivo.
Si può quindi definire la variabile di stato entropia (S) tale che:
|
(6) |
![]()
cioè tale che la sua variazione dallo stato 1 allo stato 2 corrisponda allí integrale calcolato lungo un percorso, ovviamente reversibile, che va da 1 a 2.
Lí entropia è definita a meno di una costante. Esisterà quindi uno stato S0 con valore di entropia fissato convenzionalmente uguale a 0.
Lí unità di misura dellí entropia si ricava facilmente dalla sua definizione:
|
(7) |
![]()
Si definisce inoltre lí entropia specifica:
|
(8) |
![]()
la cui unità di misura è ovviamente:
|
(9) |
![]()
Quando una trasformazione avviene senza scambio di calore (trasformazione adiabatica) si ha che dQ=0, cioè che lí entropia è costante (la trasformazione è isoentropica).
Lí espressione della curva che rappresenta una trasformazione adiabatica (e quindi anche isoentropica) sul piano P/V è del tipo:
|
(10) |
![]()
dove g è un coefficiente maggiore di 1 che dipende dalla sostanza considerata (ad esempio per lí aria, e in generale per tutti i gas biatomici, vale 1.4).
Il seguente grafico (fig. 2) mostra la curva di una trasformazione adiabatica confrontandola con quella di una trasformazione isotermica (di equazione PV=costante).
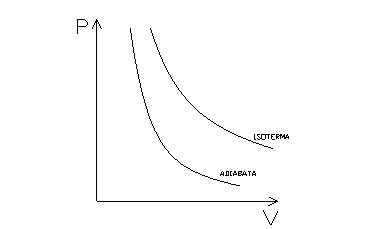
fig.2
Da quanto detto segue ovviamente che tutte le trasformazioni adiabatiche reversibili sono isoentropiche. Tuttavia possono esistere trasformazioni isoentropiche non adiabatiche o addirittura non reversibili.
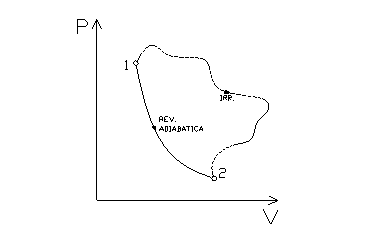
fig. 3
In fig. 3 sono rappresentate due trasformazioni che vanno dallo stato 1 allo stato 2. La prima è reversibile (quindi isoentropica): lí entropia dei due stati è la stessa.
La seconda è invece irreversibile (si noti che è stata rappresentata mediante una linea tratteggiata, in quanto una trasformazione irreversibile non potrebbe essere disegnata, visto che passa per stati che non sono di equilibrio) ma è sempre isoentropica, visto che va sempre dallo stato 1 allo stato 2 e che lí entropia, essendo una variabile di stato, non dipende dal percorso seguito.
Durante questa trasformazione lí entropia del sistema non è quindi cambiata, potrebbe però essere cambiata lí entropia dellí universo.
Si considerino le due trasformazioni rappresentate in fig. 4: una è reversibile mentre lí altra è irreversibile ma internamente invertibile (ha quindi senso disegnare il percorso ed integrarlo, essendo la trasformazione quasi statica).
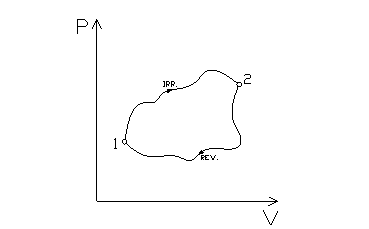
fig. 4
Scrivendo la disuguaglianza di Clausius si ottiene:
|
(11) |
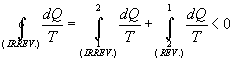
da cui:
|
(12) |
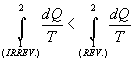
Tenendo in considerazione la (6) si può scrivere:
|
(13) |
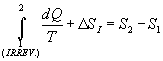
Si ha quindi una produzione entropica, espressione, in realtà impropria, che si riferisce alla quantità D SI rappresentante la componente mancante per verificare lí uguaglianza. Questa quantità può essere interpretata come lí aumento dellí entropia dellí universo.

fig. 5
In generale se fuori dal sistema si ha reversibilità, allora:
|
(14) |
![]()
Se invece fuori dal sistema si ha irreversibilità, allora:
|
(15) |
![]()
In ogni caso, quindi:
|
(16) |
![]()
Dove D SUNIVERSO indica la variazione dellí entropia dellí universo (Principio di non diminuzione dellí entropia dellí universo).
Questo principio è equivalente al secondo principio della termodinamica. Infatti violando questí ultimo si contraddice la relazione (16).
Si consideri ad esempio una macchina (fig. 6) che produce lavoro a partire dal calore sottratto ad un solo serbatoio (Questo sistema viola evidentemente lí enunciato di Kelvin-Plank):
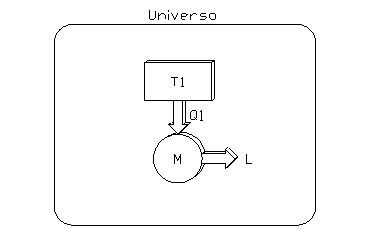
fig. 6
La macchina considerata è una macchina termica semplice che opera ciclicamente eseguendo trasformazioni reversibili. Dato che dopo ogni ciclo torna allo stato iniziale, la sua variazione di entropia è nulla:
|
(17) |
![]()
(il fatto che ci sia una produzione di lavoro è entropicamente irrilevante).
Per quanto riguarda il serbatoio si ha invece, per la (6):
|
(18) |
![]()
(il segno negativo è dovuto al fatto che il calore viene prelevato dal serbatoio).
Lí entropia dellí universo, essendo la somma di (17) e (18), è quindi negativa: impossibile per il principio di non diminuzione dellí entropia.
Si consideri ora un sistema costituito da due serbatoi, in cui il calore passa dal serbatoio più freddo al serbatoio più caldo (fig. 7):
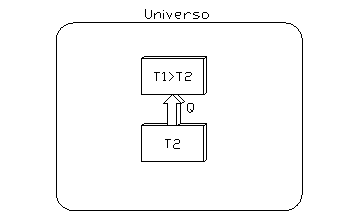
fig. 7
(in questo caso si è in ovvia contraddizione con lí enunciato di Clausius).
Le variazioni di entropia subita dai due serbatoi valgono:
![]()
|
(19) |
![]()
Per cui la variazione di entropia dellí universo vale:
|
(20) |
![]()
Essendo T1>T2 la quantità tra parentesi è minore di zero, e quindi la variazione di entropia è negativa (impossibile per il principio di non diminuzione).
Analogamente si dimostra che se il secondo principio della termodinamica è verificato allora è verificato anche il principio di non diminuzione dellí entropia.
Teorema di Carnot
Si consideri una macchina termica semplice che compie trasformazioni reversibili, senza violare il secondo principio (fig. 1):
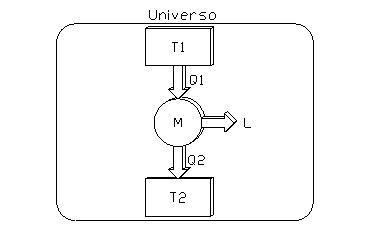
fig. 1
Una macchina di questo tipo è detta macchina di Carnot.
In queste ipotesi la variazione di entropia dellí universo deve essere ovviamente nulla, cioè deve essere:
|
(1) |
![]()
da cui lí espressione del teorema di Carnot:
|
(2) |
![]()
che può essere scritto anche equivalentemente:
|
(3) |
![]()
La macchina di Carnot può effettuare solamente processi isotermici o adiabatici. In fig. 2 è mostrato il ciclo di Carnot:
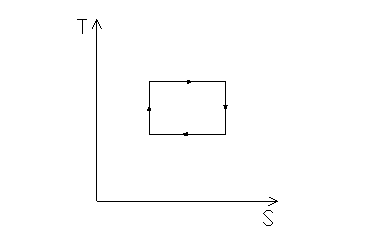
fig. 2
Su un piano P/V (fig. 3):
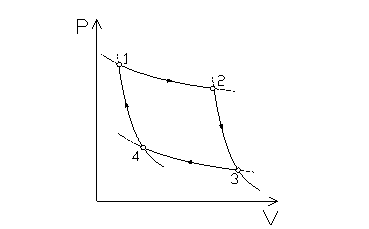
fig. 3
Le trasformazioni eseguite in un ciclo di Carnot sono:
Il coefficiente economico, definito come:
|
(4) |
![]()
per la macchina di Carnot diventa, sfruttando la (3):
|
(5) |
![]()
Le macchine reali in genere hanno coefficienti economici molto minori di e C.
Non può esistere, in nessun caso, una macchina con coefficiente economico maggiore di quello di Carnot.
Si supponga infatti di avere una macchina con con e >e C che preleva da un serbatoio caldo a temperatura T1 una quantità di calore Q1 e ceda a un serbatoio freddo a temperatura T2 una quantità di calore Q2, compiendo un lavoro L.
Essendo e >e C, sarà L>e CQ1.
Il lavoro L può quindi essere scomposto in due componenti:
|
(6) |
![]()
La componente e CQ1 può poi essere utilizzata in una seconda macchina per riportare nel serbatoio caldo la quantità di calore Q1 precedentemente prelevata: si otterrebbe una macchina in grado di produrre il lavoro L0 prelevando calore da un solo serbatoio (in contrasto con il secondo principio della termodinamica).
ESEMPIO:
Si consideri una centrale che produce energia elettrica bruciando gasolio, grazie alla cui combustione si ottiene una temperatura di 1800 K. La temperatura ambiente è di 300 K.
Sulla base di questi dati si può affermare che il massimo coefficiente economico teorico ottenibile vale:
![]()
In realtà si ottiene un coefficiente molto minore. Infatti sottraendo calore ai fumi caldi prodotti dalla combustione questi diminuiscono di temperatura, non rimangono a 1800 K:
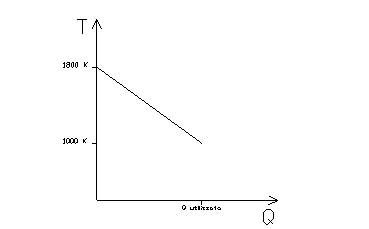
fig. 4
Analogamente fornendo calore allí ambiente la sua temperatura si innalza e non rimane a 300 K.
Si supponga ad esempio che la temperatura ottenuta in caldaia sia di 1000 K e che la temperatura dellí ambiante sia di 400 K.
Il coefficiente economico vale quindi:
![]()
(In realtà le migliori centrali raggiungono un coefficiente economico pari a 0.57-0.58)
La situazione descritta può essere rappresentata dal seguente schema:
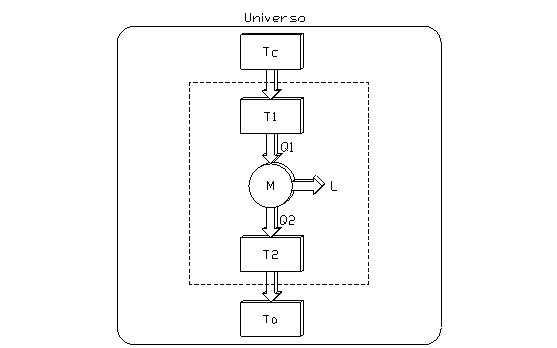
fig. 5
in cui Tc=1800K, T1=1000K, T2=400K, T0=300K.
La porzione racchiusa dal rettangolo tratteggiato rappresenta la macchina di Carnot ideale, che compie quindi trasformazioni reversibili. Il sistema è però esternamente irreversibile.
Exergia e anergia
Il coefficiente economico indica in pratica la frazione dellí energia termica totale convertibile in lavoro.
Non tutta lí energia che si ha a disposizione sottoforma di calore, infatti, può essere trasformata in lavoro: una parte di essa deve essere ceduta al serbatoio freddo e deve quindi rimanere sottoforma di calore.
La porzione dellí energia totale che può essere trasformata in lavoro si chiama exergia, mentre la restante parte prende il nome di anergia.
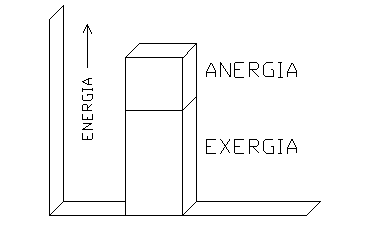
fig. 1
Nellí esempio precedente lí exergia rappresentava il 60% dellí energia complessiva.
In generale qualunque tipo di energia presenta una certa quantità di exergia.
Lí energia nobile (come quella elettrica, potenziale, ecc.) presenta un elevato contenuto exergetico (in certi casi oltre il 99%, molto vicino al 100%).
Il calore ha invece un contenuto exergetico abbastanza basso.
In generale più è bassa la temperatura a cui deve lavorare la macchina e più è alta la convertibilità in lavoro dellí energia termica.
Non è comunque detto che lí anergia sia una energia "inutile": essa può essere utilizzata comunque per usi termici a bassa temperatura (come ad esempio per il riscaldamento domestico).

fig. 2
Si può adottare una tecnica di questo tipo ad esempio nella produzione di energia elettrica: dopo aver utilizzato lí energia termica per produrre elettricità, il calore di rifiuto è riutilizzabile per effettuare servizi di teleriscaldamento.
La città di Brescia sta utilizzando con successo questo sistema dagli anni í70.
Adottando una politica energetica di questo tipo su scala nazionale si avrebbe un risparmio di risorse energetiche del 35-40%.
Purtroppo, infatti, si ha uno spreco enorme di energia. In molte situazioni si spreca calore senza produrre lavoro (come ad esempio nei sistemi di riscaldamento a gas), o si produce lavoro disperdendo nellí ambiente il calore di rifiuto.
Trasformazioni irreversibili Ė perdita di lavoro
Si consideri un sistema come quello rappresentato in fig. 1, in cui si ha una irreversibilità esterna.
Questa irreversibilità è causa, oltre che di un aumento dellí entropia dellí universo, anche di una perdita di lavoro.
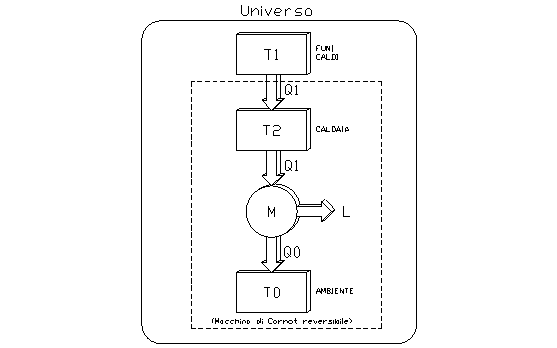
fig. 1
Infatti, chiamando L il lavoro prodotto dalla macchina di Carnot reversibile e Lí il lavoro complessivo del sistema, si può scrivere:
![]()
|
(1) |
![]()
Sottraendo L a Lí si ottiene il lavoro perso:
|
(2) |
![]()
Si può poi calcolare la variazione di entropia:
|
(3) |
![]()
Essendo L=e CQ1 e e C=1-T0/T2 si ha:
|
(4) |
![]()
Inserendo la (4) nella (2) si ottiene la relazione che lega il lavoro perso con la variazione di entropia:
|
(5) |
![]()