Il francese Brigogine fu’ il maggior studioso del secondo principio sotto un aspetto scientifico – filosofico (il concetto filosofico base e’ che il tempo non può tornare indietro).
Il primo principio (legge della conservazione dell’energia) afferma
che energia sotto forma di calore ed energia sotto forma di lavoro sono
perfettamente equivalenti (stessa unita’ di misura e possibilita’ di convertire
una forma nell’altra indiscriminatamente); l’equivalenza e’ limitata dal
secondo principio che determina il senso in cui possono svolgersi i processi
spontanei:
|
Lavoro Þ calore
|
sempre possibile |
|
Calore Þ lavoro
|
impedita |
Storicamente il secondo principio venne enunciato quasi contemporaneamente in due forme apparentemente diverse ma che vedremo essere equivalenti:
Clausius (1850)
Kelvin-Plank (1851)
Prima di enunciare il secondo principio è necessario dare alcune importanti definizioni:
1)Serbatoio di calore: è un sistema chiuso, teoricamente di dimensioni finite, il quale può scambiare quantità arbitrariamente grandi di calore mantenendo costante la sua temperatura.

Questa è un’astrazione realizzabile solo entro certi limiti; nella realtà possiamo andare vicino a costruire un serbatoio di calore almeno in due modi differenti:
a)Serbatoio di calore freddo: è un sistema costituito
da un recipiente con all’interno acqua liquida e cubetti di ghiaccio (il
sistema è mantenuto alla pressione
di 1BAR).
In questo modo se prelevo calore si solidifica parte
dell’acqua liquida, invece se fornisco calore si scioglie del ghiaccio;
in tal modo la temperatura del sistema rimane costante a 0 °C.
La quantità di calore che posso fornire non
è arbitraria in quanto una volta che si è sciolto tutto il
ghiaccio la temperatura comincerà inevitabilmente a salire (analogamente
se prelevo calore).
b)Serbatoio di calore caldo : sistema costituito da un recipiente con all’interno acqua liquida e vapore acqueo (il sistema è mantenuto alla pressione di 1BAR).
In questo modo se prelevo calore parte dell’acqua
passa dallo stato gassoso allo stato liquido, invece se fornisco calore
parte dell’acqua passa dallo stato liquido allo stato gassoso; in tal modo
la temperatura del sistema rimane costante a 100°C.
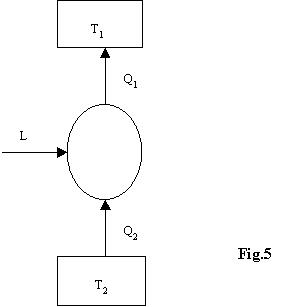
Considerando due serbatoi di calore è possibile definire
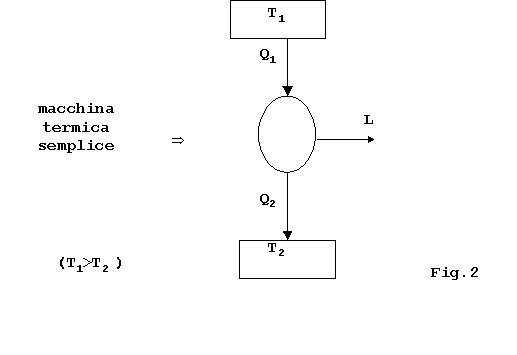
2)Macchina termica semplice : sistema chiuso che scambia calore
tra due serbatoi a temperatura costante (ma differente fra loro).
La macchina termica semplice compie
trasformazioni quasi statiche (trasformazioni molto lente, si passa con
continuità da uno stato al successivo).
Il processo è ciclico (DU=0),
cioè alla fine della trasformazione lo stato è lo stesso
dell’inizio e il significato è la produzione di lavoro a spese del
calore.
Lo schema è il seguente:
Anche la macchina termica semplice è un’astrazione
in quanto le macchine reali interagiscono con oggetti che non rispondono
perfettamente alla definizione di serbatoi (in quanto abbiamo visto non
essere praticamente realizzabili) e poi nella realtà non posso considerare
trasformazioni così lente da poterle considerare quasi statiche.
In ogni caso l’utilizzo di queste macchine nella
nostra vita civile è fondamentale e quindi si nota l’importanza
di ottimizzarne il funzionamento; si introduce per questo un coefficiente
che ne valuta l’efficienza:
![]() (1)
(1)
e è detto COEFFICIENTE
ECONOMICO e mi dice quanto lavoro ho ottenuto rispetto alla quantità
di calore che ho fornito.
Il coefficiente economico è sempre minore
di 1 ( 0.4 – 0.5 ) in quanto tenendo conto del primo principio e del fatto
che la macchina termica semplice compie trasformazioni cicliche (quindi
per ogni ciclo
DU=0) otteniamo:
L = Q1 - Q2
e = L / Q = (Q1 – Q2) / Q1 = 1 – (Q2 / Q1)
Per avere e = 1 ci vorrebbe Q2
= 0, ma il secondo principio nega tale eventualità.
Enunciato di Kelvin-Plank
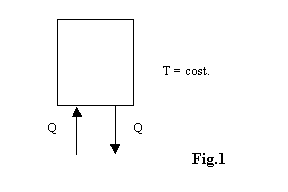
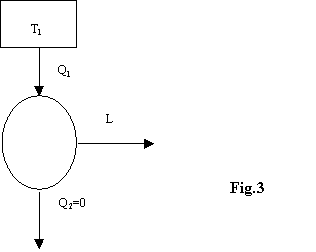
Non è possibile effettuare una trasformazione il cui unico risultato sia la conversione di calore in lavoro.
Questo implica che non si può produrre lavoro
meccanico estraendo calore da un unico termostato, senza restituirne una
certa quantità a un termostato che si trova a temperatura minore.
Non è possibile quindi che esista una macchina
di questo tipo:
Enunciato di Clausius
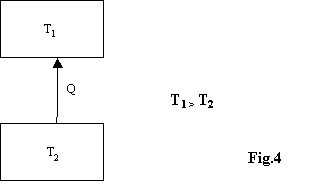
Non è possibile effettuare una trasformazione il cui unico risultato sia il passaggio di calore da un serbatoio freddo ad uno caldo.
Questo enunciato riguarda un fenomeno noto come principio
zero della termodinamica, cioè il calore passa spontaneamente da
un corpo caldo ad uno freddo e non viceversa.
Non è possibile quindi che esista un oggetto
di questo tipo:
Nell’enunciato di Clausius riveste fondamentale importanza
il termine unico, in quanto nelle macchine frigorifere avviene il
trasferimento di calore dal serbatoio freddo al serbatoio caldo, ma si
verifica un assorbimento di lavoro dall’esterno.
Lo schema di funzionamento di tali macchine è
il seguente:
Verifichiamo la perfetta equivalenza fra i due enunciati dimostrando che negandone uno si viola anche l’altro.
Supponiamo falso l’enunciato di Kelvin-Plank, cioè
consideriamo una macchina termica formata dal motore ideale (violazione
di Kelvin-Plank) e dal frigorifero (o macchina frigorifera) reale :
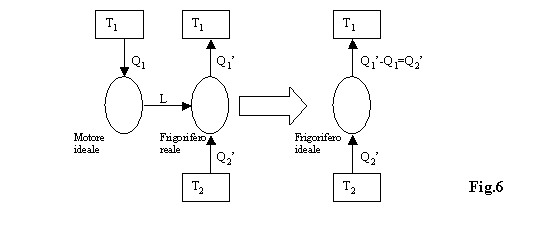
Il lavoro L viene prodotto e scambiato all’interno
di questa macchina e non entra nello scambio di energia con l’ambiente
esterno.
La macchina assorbe il calore Q2’
dal
serbatoio a bassa temperatura e cede al serbatoio a temperatura più
alta una quantità di calore uguale a Q1’ – Q1.
Ma Q1 = L , per cui considerando
che la macchina frigorifera lavora ciclicamente (DU
= 0 ) per il primo principio della termodinamica posso scrivere:
0 = D U = Q1’ – Q1 = Q1’ – L = Q2’
in quanto L = Q1’ – Q2’
Perciò la nostra macchina complessiva si comporta
come un frigorifero ideale che assorbe una quantità di calore Q2’
dal
serbatoio a bassa temperatura e cede il calore Q2’
al
serbatoio a temperatura più alta, senza che venga fatto lavoro esterno.
L’esempio mostra che, se si può costruire
un motore perfetto, allora si può anche costruire un frigorifero
perfetto; questo equivale a dire che la violazione dell’enunciato di Kelvin-Plank
del secondo principio implica la violazione dell’enunciato di Clausius.
Allo stesso modo si può dimostrare che se si suppone di poter costruire una macchina frigorifera che viola l’enunciato di Clausius, allora si può trasformare un motore reale in un motore che viola l’enunciato di Kelvin-Plank.
Dal momento che la violazione di ognuno dei due enunciati
implica la violazione anche dell’altro, essi sono logicamente equivalenti.
Esistono due modalità di moto perpetuo:
· moto perpetuo di prima specie: si ha produzione di lavoro dal nulla(viene violato il primo principio perché il lavoro è energia e l’energia si conserva)
· moto perpetuo
di seconda specie: macchina con rendimento e
= 1(è lecito dal punto di vista energetico però viene violato
il secondo principio della termodinamica).
Fisicamente il moto perpetuo di seconda specie sarebbe
possibile se
T2 = 0° K
e riesce a mantenersi a tale temperatura senza dovergli somministrare calore
Q2;
in questo caso tutto il calore si trasforma in lavoro perché la
temperatura non può più abbassarsi.
Trasformazioni reversibili e irreversibili
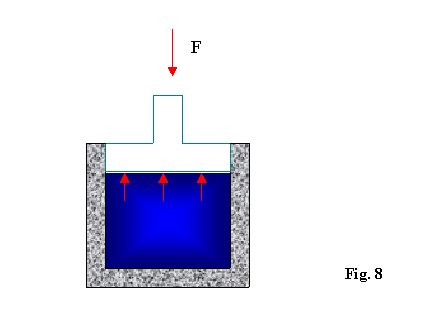
Le trasformazioni quasi statiche sono trasformazioni molto lente nelle quali per compiere la trasformazione totale avvengono una serie(teoricamente infinita) di trasformazioni infinitesime nelle quali la pressione P non cambia.
Affinché una trasformazione sia quasi statica è necessario che:
![]() (2)
(2)
dove:
F rappresenta la forza esterna agente sul pistone e preme verso
il basso(è una forza di contrasto che fa sollevare il pistone lentamente
e non in modo esplosivo)
P rappresenta la pressione del gas all’interno del contenitore
A rappresenta la superficie del pistone
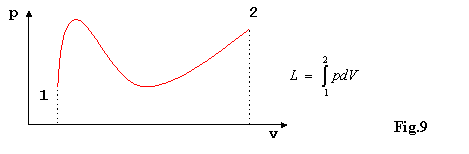
Rappresentando questa trasformazione su un diagramma(ad
esempio P-V) ottengo un percorso ben definito sul quale posso
utilizzare gli strumenti che la matematica mi mette a disposizione(ad esempio
in fig.9 l’integrazione per il calcolo del lavoro).
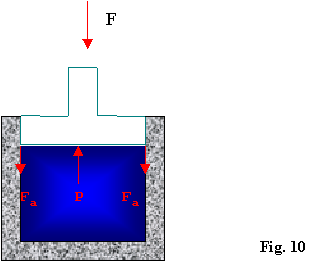
Nell’analisi dell’esempio sopra bisogna considerare anche l’attrito che si genera fra il pistone e le pareti del contenitore quando il pistone si solleva in seguito all’espansione del gas; questo fenomeno fà sì che una parte di lavoro(energia "nobile") si trasformi irreversibilmente in calore, fatto importante alla luce del secondo principio.
Le forze d’attrito(indicate con Fa) sono rivolte verso il basso in quanto contrastano il moto del pistone(Fig.10).
In questo caso siamo in presenza di una irreversibilità
interna(in quanto per il secondo principio il calore non può
convertirsi spontaneamente in lavoro).
La reversibilità interna è fisicamente
realizzabili in quanto operando con particolare cura è possibile
contenere gli attriti a valori talmente bassi tali da risultare trascurabili.
Consideriamo ora lo schema seguente:
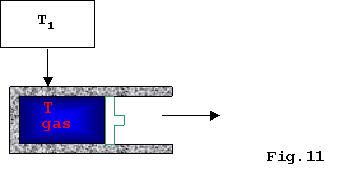
Per rendere l’espansione del gas apprezzabile, cioè
per far muovere il pistone in modo sufficientemente rapido da poter osservare
il fenomeno, è necessario un notevole flusso di calore(l’intervallo
di temperatura
DT = T1
– T deve essere sufficientemente ampio) e questo fatto genera un
tipo di irreversibilità detta irreversibilità esterna
in
quanto viene a mancare l’equilibrio termico.
Le irreversibilità esterne, a differenza
di quelle interne, non possono essere rese trascurabili in quanto per poter
far ciò è necessario che venga mantenuto l’equilibrio termico
con l’esterno, cioè nell’esempio sopra dovrei considerare variazioni
infinitesime di temperatura dT ma ciò renderebbe il movimento
del pistone talmente lento da rendere il fenomeno trascurabile.
Nell’esempio considerato sollevando il pistone si ha PGAS> PEST mentre abbassandolo si ha PEST > PGAS , ed ad ogni movimento corrisponde un energia dissipata per attrito:
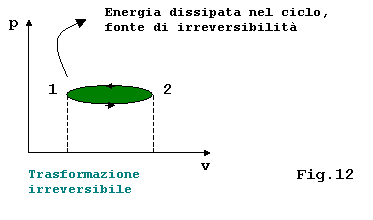
Se manca l’invertibilità interna ogni integrale è privo di significato, a meno che la funzione integranda non sia una funzione di stato, questo perché di esse non conosco niente se non gli stati iniziale e finale(fig.13); quindi ad esempio il lavoro dipendendo dal percorso seguito non è calcolabile.

Il grafico sopra è stato disegnato in modo
ambiguo in quanto il cammino da 1 a 2 può avere una forma qualsiasi
e di cui non conosciamo nessun elemento.
Disuguaglianza di Clausius
Consideriamo una trasformazione reversibile(passa per stati di successivo equilibrio e la posso dunque rappresentare sul diagramma PV)con un certo cammino:
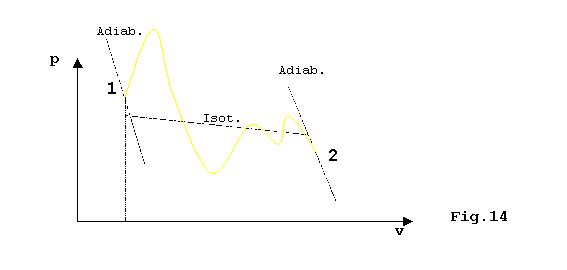
Considerando ora una trasformazione reversibile ciclica, è possibile rappresentare delle trasformazioni isoterme e adiabatiche in modo tale che il salto di energia interna sia lo stesso del nostro cammino; si prende cioè un cammino a zig-zag tra isoterme e adiabatiche in modo da seguire il cammino originale approssimato con tratti piccoli a piacere(per ottenere una migliore approssimazione basta avvicinare tra loro le adiabatiche connettendole con dei piccoli tratti isotermi):

Lungo tutto il ciclo:
QCICLO = QISOTERME (QADIAB. = 0 per definizione)
invece lungo le isoterme vale la relazione:
![]() (3)
(3)
in quanto tornando al punto di partenza è accaduto che un certo
dQ è stato ceduto ma poi riacquistato.
L’espressione seguente, nota con il nome di disuguaglianza
di Clausius, parla, paradossalmente, di integrale lungo un cammino
irreversibile:
![]() (4)
(4)
L’uguaglianza mi consente invece di introdurre una nuova funzione di stato;considerando infatti due diversi cammini reversibili chiusi che seguano lo stesso percorso c nell’andare da 1 a 2 e seguano percorsi differenti nell’andare da 2 a 1:
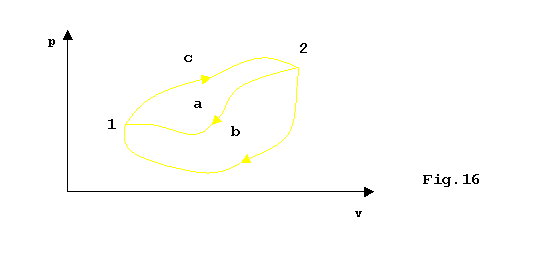
ottengo che:
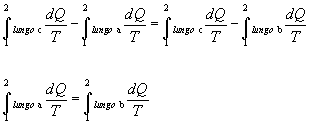
Þ indipendenza dal cammino seguito Þ è una funzione di stato
La variazione di questa funzione di stato si chiama entropia:
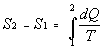 (5)
(5)
L’integrale per il calcolo dell’entropia[J/°
K] va ovviamente fatto lungo un percorso reversibile, altrimenti non esiste.
Considero ora una trasformazione che va da 1 a 2
irreversibile, pur essendo fatta da stati di successivo equilibrio(ha solo
irreversibilità esterna):
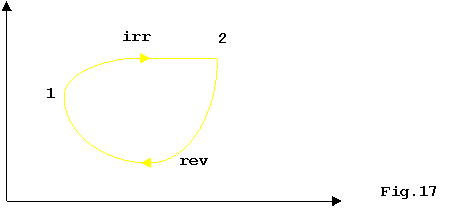
Ho che:
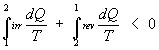
con
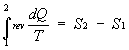
allora ottengo:
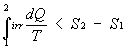
quindi posso scrivere:
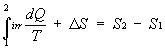
DS è detta
impropriamente produzione entropica in quanto si afferma che se
si va dal punto 1 al punto 2 lungo una trasformazione irreversibile si
produce entropia, ma il concetto non è corretto perché l’entropia
è una funzione di stato e non si produce; DS
ha senso se ragiono sull’ambiente.
DSu è la variazione di entropia dell’universo e si ha che:
· se il sistema compie una trasformazione reversibile(sia internamente che esternamente) DSu = 0
· se il sistema compie una trasformazione
esternamente irreversibile DSu>
0
Concludo dicendo che, utilizzando il concetto di entropia, siamo in grado di enunciare il secondo principio nella sua forma più generale:
In qualsiasi trasformazione termodinamica
che evolva fra due stati di equilibrio, l’entropia dell’insieme costituito
dal sistema più l’ambiente circostante può solo restare costante
o aumentare.
Non esiste in natura nessuna trasformazione nella
quale diminuisca l’entropia totale del sistema più l’ambiente circostane.
Ricordando che sistema + ambiente = universo , si ha che l’entropia
dell’universo può solo crescere.