Paolo Baratti - matricola 118985 - Lezione: 25/10/99 - ore: 16.30-18.30
ESERCIZIO 1 – "Scatolone adiabatico 1"
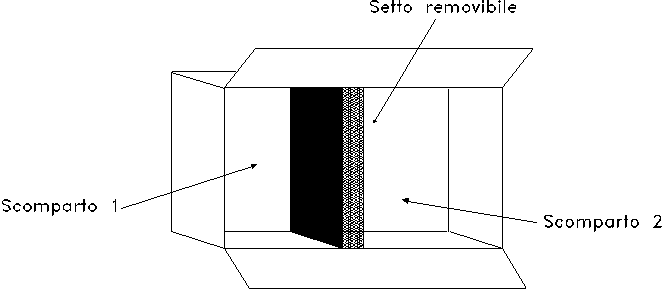
Lo "scatolone adiabatico" è un sistema chiuso termicamente isolato, costituito da un contenitore cavo che presenta al suo interno due scomparti adiacenti (denominati 1 e 2) separati da un setto termicamente e meccanicamente isolante (fig. 1).

Nello scomparto 1 è presente 1 m3 di aria alla pressione p1 di 1 bar ed alla temperatura T1 di 100 °C, mentre nello scomparto 2 sono presenti 2 m3 di aria alla pressione p2 di 10 bar ed alla temperatura T2 di 200 °C.
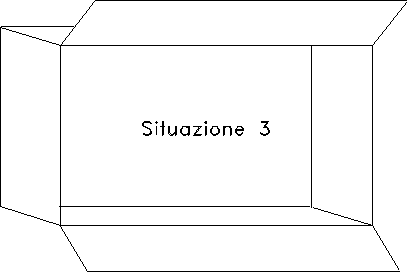
Ad un certo istante si rimuove il setto e le due quantità d’aria contenute nello scatolone si mescolano (situazione 3 in fig. 2).
Supponendo che l’aria sia una sostanza chimicamente pura, determinare le coordinate termodinamiche (T3, V3, v3, p3) che descrivono lo stato finale del sistema.
Si valuti, inoltre, se si è verificato un aumento di entropia del sistema ed in caso affermativo calcolarlo.
Soluzione
Innanzitutto, avendo supposto che l’aria sia una sostanza chimicamente pura si può constatare che durante la rimozione del setto non avvengono processi che portano ad una modificazione della composizione del contenuto, quindi allo stato 3 si ha semplicemente aria.
Prima di risolvere l’esercizio preoccupiamoci di verificare che tutte le grandezze vengano espresse nelle unità di misura del SI:
Impostiamo, quindi, la soluzione partendo dal 1° principio della termodinamica che assume la forma:
avendo posto Q = 0 e L = 0, in quanto il sistema è termicamente e meccanicamente isolato.
Abbiamo quindi:
essendo l’energia interna U una grandezza che gode della proprietà additiva.
Ricordando che:
dove u è l’energia interna specifica del sistema e M è la massa del sistema, riscriviamo la (1):
Per calcolare M1 e M2 utilizziamo l’equazione di stato dei gas perfetti:
dove la costante universale dei gas perfetti vale:
Dapprima ricaviamo il numero di moli dei sotto-sistemi 1 e 2 utilizzando la (3):
successivamente determiniamo le masse dei sotto-sistemi utilizzando il valore della massa molare dell’aria che sappiamo essere:
Determiniamo infine la massa del sistema allo stato finale 3:
da cui ricaviamo il numero di moli dell’aria allo stato finale:
Esplicitiamo l’equazione (2) rispetto all’energia interna specifica u3:
e sostituiamo l’energia interna specifica secondo la relazione:
dove Cv è il calore specifico dell’aria a volume costante e t è la temperatura espressa in gradi centigradi, ottenendo:
La semplificazione è resa possibile dal fatto che Cv
è indipendente dalla temperatura.
Sostituendo ora i valori ricavati in precedenza si ottiene:
Notiamo che la temperatura del sistema una volta rimosso il setto è molto vicina alla temperatura del sotto-sistema 2 alla situazione iniziale, ma questo dato era prevedibile essendo M2 >> M1.
La temperatura t3, inoltre, rappresenta la media pesata delle temperature di partenza, il cui peso è rappresentato dalle masse dei sistemi considerati.
Procediamo ora determinando il volume finale V3 ricavandolo direttamente dai dati del problema:
Il volume specifico allo stato finale è dato da:
Una volta ottenute due variabili termodinamiche indipendenti, nel nostro caso la temperatura T3 ed il volume V3, si può facilmente calcolare la coordinata restante, vale a dire la pressione p3 servendoci dell’equazione (3):
Per rispondere al quesito osserviamo che il sistema in questione è termicamente isolato pertanto l’entropia o si è mantenuta costante oppure è aumentata; in realtà possiamo affermare con sicurezza che essa è aumentata in quanto il processo che si è verificato è irreversibile, dal momento che una volta rimosso il setto separatore le due quantità d’aria iniziali si sono mescolate e dalla situazione finale non è più possibile ritornare a quella di partenza.
Poiché l’entropia è una funzione di stato non è necessaria una descrizione approfondita della trasformazione verificatasi, ma è sufficiente conoscere i valori iniziali e finali secondo la relazione:
Determiniamo i valori dell’entropia specifica sfruttando le relazioni ottenute nei capitoli precedenti:
dove Raria è la costante specifica dell’aria che vale 287 J/kgK, T0 è la temperatura di riferimento (nel nostro caso 273 K), p0 è la pressione di riferimento (1 bar) e Cp è il calore specifico a pressione costante pari a 1010 J/kgK.
Sostituendo nella (4) i valori ottenuti si ha:
ESERCIZIO 2 – "Pompa da bicicletta"
Consideriamo la pompa da bicicletta schematizzata in fig. 3, che presenta nella parte terminale un recipiente pieno d’aria di volume V0 = 1 m3.
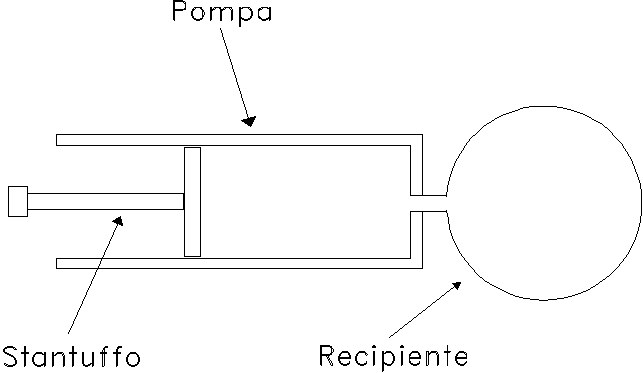
Il volume V1 dell’aria inizialmente presente all’interno della pompa è pari a 2 m3.
Il sistema si trova, infine, ad una temperatura iniziale TINIZ = 20 °C e ad una pressione iniziale pINIZ = 1 bar.
Ad un certo istante si inizia ad imprimere una forza sul manico della pompa spingendo lo stantuffo fino a quando l’aria contenuta nella pompa risulta essere tutta compressa all’interno del recipiente (fig. 4).
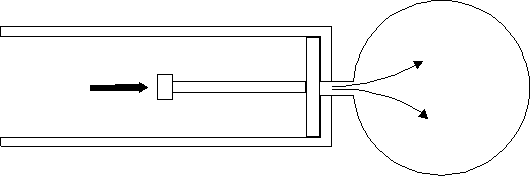
In fig. 5 è possibile vedere la descrizione grafica del processo.
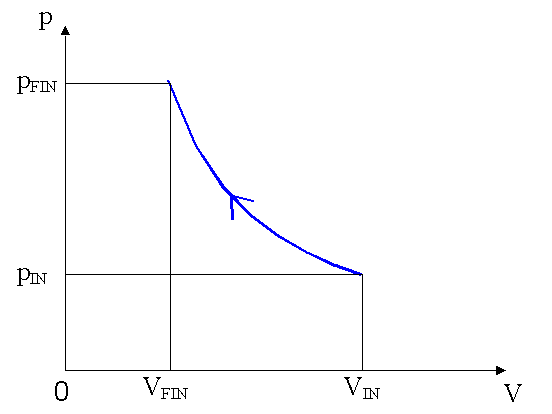
Ipotizzando che il processo sia così rapido da non permettere al sistema di scambiare calore con l’esterno, si determinino la temperatura finale, la pressione finale ed il lavoro compiuto sul sistema per far avvenire la trasformazione.
Soluzione
Innanzitutto trasformiamo i dati:
Osserviamo, quindi, che la trasformazione descritta dal testo dell’esercizio è una adiabatica reversibile, pertanto la dipendenza tra pressione e volume del gas è espressa dalla relazione:
dove l’esponente g è dato dal rapporto tra calore specifico a pressione costante e calore specifico a volume costante e nel caso dell’aria vale:
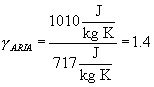 .
.Determiniamo il volume iniziale occupato dal gas:
Al termine della trasformazione l’aria è completamente contenuta nel recipiente posto al termine della pompa, pertanto:
Utilizzando l’equazione della trasformazione (5), si ottiene la pressione finale:
Utilizzando l’equazione di stato dei gas perfetti determiniamo la massa
del gas:
dove R è la costante caratteristica dell’aria che vale 287 J/kg K.
Osserviamo che durante la trasformazione la massa rimane costante in quanto il sistema è chiuso.
Utilizzando ancora l’equazione dei gas perfetti, scritta questa volta per lo stato finale, troviamo la temperatura finale:
Prima di determinare il valore del lavoro compiuto sul sistema osserviamo che esso è composto da due contributi:
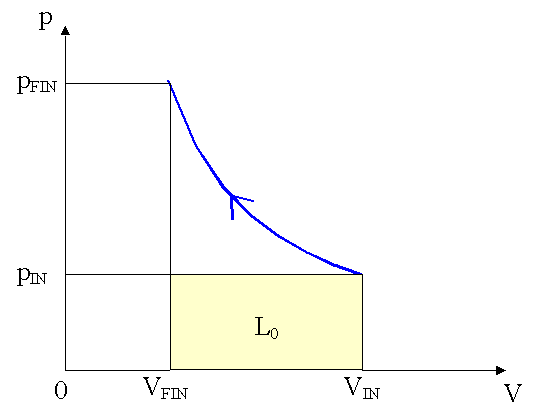
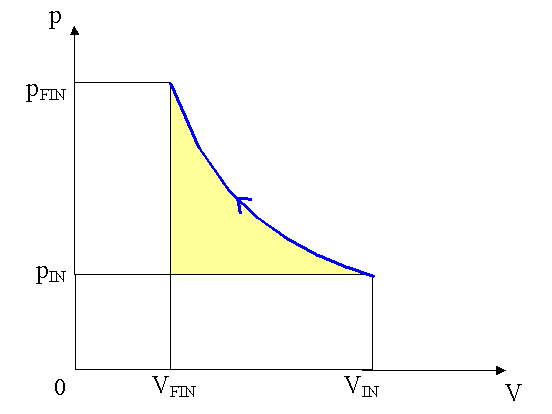
Calcoliamo il lavoro compiuto dalla pressione atmosferica:
Chiaramente il lavoro è negativo per la convenzione dei segni, in quanto viene compiuto sul sistema.
Il lavoro totale compiuto sul sistema, invece, è dato dall’equazione del 1° principio della termodinamica, tenendo presente che Q = 0 in quanto il processo è adiabatico:
Sostituendo i dati ricavati in precedenza otteniamo:
Il lavoro netto effettivamente compiuto si determina per differenza:
otteniamo un valore negativo in quanto il lavoro viene compiuto dall’esterno sul sistema.
ESERCIZIO 3 – "Scatolone adiabatico 2"
Consideriamo un sistema avente le stesse caratteristiche di quello descritto nell’esercizio 1 (fig. 8).
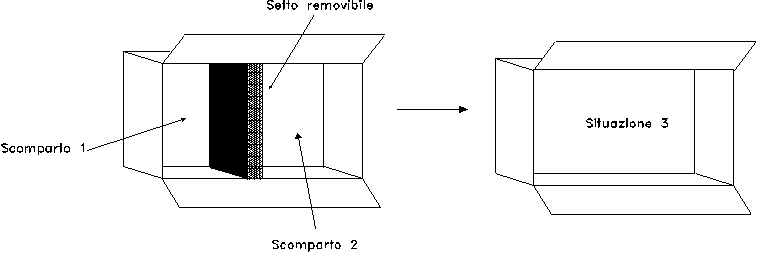
Nello scomparto 1 vi è 1 kg di vapor d’acqua saturo alla pressione di 9.8 bar, mentre nello scomparto 2 vi sono 2 kg di vapor d’acqua alla pressione di 0.98 bar.
Determinare lo stato fisico finale 3 del sistema dopo la rimozione del setto sapendo che il titolo dal gas nello scomparto 1 è 0.1, mentre il titolo del gas nello scomparto 2 è 0.5.
Si determini, inoltre, la variazione di entropia del sistema.
Soluzione
Prima di addentrarci nella soluzione numerica dell’esercizio, è bene compiere alcune considerazioni sul diagramma [p,V] dell’acqua per determinare quella parte di grafico in cui dovrà trovarsi il risultato.
La localizzazione del bersaglio (fig. 9) risulta molto utile soprattutto quando, come in questo esercizio, non è possibile procedere analiticamente, ma si è costretti a determinare la soluzione "per tentativi" sfruttando i dati presenti nelle tabelle.
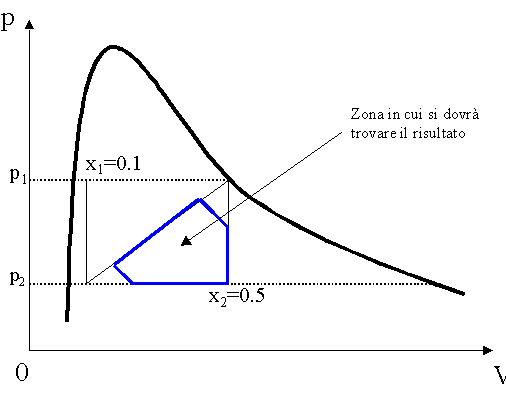
Al termine della soluzione, infatti, se i dati ricavati cadranno al di fuori della zona di grafico evidenziata avremo sicuramente commesso degli errori, pertanto sarà necessario ripetere i calcoli.
Trasformiamo ora i dati:
Innanzitutto:
Poiché il sistema è termicamente e meccanicamente isolato Q = 0 e L = 0 (cfr. testo "Esercizio 1"), pertanto il 1° principio della termodinamica assume la forma:
Introducendo le grandezze specifiche la (7) può essere riscritta in questo modo:
Calcoliamo u1 e u2 sfruttando i dati contenuti nella tabella A:
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
dove l’energia interna specifica differenziale ud1 è data da:
Nella (10) compaiono nuove grandezze: hd è l’entalpia specifica differenziale (quinta colonna nella tabella A), mentre vd è il volume specifico differenziale dato da vgas – vliq (le ultime due colonne della tabella A).
Per determinare i valori da sostituire nelle espressioni scegliamo la riga da consultare in base al valore della pressione dato dal testo dell’esercizio: abbiamo che p1 = 9.8 bar, pertanto, una volta individuato nella tabella il valore in questione (nel nostro caso ps = 9.5736 relativo alla temperatura di 178 °C), andiamo a leggere sulla riga corrispondente i valori di vliq e di vgas ottenendo:
Individuando sulla tabella i valori di uliq1, che sappiamo essere uguale a hliq1 (quarta colonna della tabella A) e di hd1, li sostituiamo, insieme a vd1 appena determinato, prima in (10) e poi in (9) ottenendo:
Analogamente determiniamo u2 scegliendo la riga in corrispondenza di t = 100 °C:
Mettendo in (8) i risultati ottenuti in (6), in (11) ed in (12) abbiamo:
da cui otteniamo:
che sappiamo essere uguale a:
Per procedere nei calcoli ci occorre una seconda grandezza indipendente:
Introducendo le grandezze specifiche riscrivo la (14):
Sfruttando ancora una volta i dati contenuti nella tabella determino:
Dalla (15), con le dovute sostituzioni, ricavo:
che sappiamo essere uguale a:
Considerando la (13) e la (16), abbiamo un sistema nell’unica incognita x3:
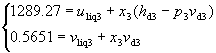
Questo sistema può essere risolto solamente "per tentativi": consideriamo una pressione finale p3 vicina a p2, ad esempio p3 = 1.2504 bar, leggiamo i valori sulla riga corrispondente a t = 106 °C e li sostituiamo in un’equazione del sistema, ad esempio la prima:
Risolviamo ed otteniamo:
Andiamo quindi a sostituire il valore di x3 ottenuto nella seconda equazione del sistema per verificare se otteniamo un’identità: in caso affermativo avremo determinato la soluzione corretta, in caso negativo dovremo ripetere nuovamente il procedimento appena descritto.
Nel nostro caso otteniamo 0.5651 » 0.5617 che costituisce una buona approssimazione, pertanto il risultato corretto è:
In particolare osserviamo che questo valore ricade nella parte di grafico evidenziata (fig. 9 pagina 9) proprio come avevamo preventivato.
Calcoliamo, infine, la variazione di entropia:
Determiniamo, con l’ausilio della tabella:
Sostituendo i valori nella (17) si ottiene:
ESERCIZIO 4
Consideriamo il tubo in fig. 10 al cui interno scorre del vapore saturo.
Il tubo presenta un’estremità comunicante con l’esterno che permette al vapore di sfiatare all’aria aperta alla pressione di 1 bar ed alla temperatura di 100 °C.
Si determini il titolo x del vapore utilizzando il "metodo del calorimetro".
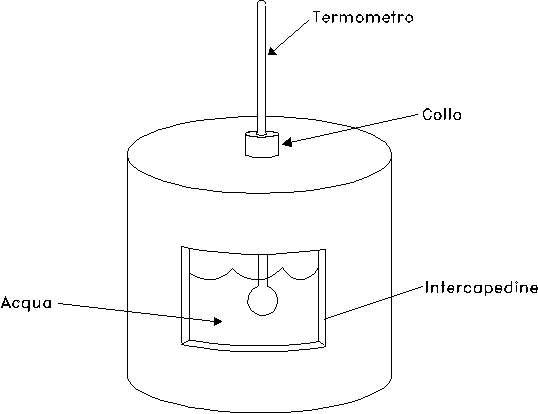
Il calorimetro (fig. 11) è un’ampolla termicamente isolante, rivestita da un’intercapedine al cui interno viene creato il vuoto, che presenta una piccola apertura denominata collo attraverso la quale viene inserito un sottile termometro a mercurio.
Inizialmente, il calorimetro contiene 0.57 kg di acqua allo stato liquido e si trova alla temperatura di 25 °C.
Viene, quindi, introdotto il tubo all’interno del calorimetro e si fa gorgogliare il vapore nell’acqua: il vapore inizia a condensarsi ed allo stato finale il calorimetro conterrà 0.615 kg di acqua alla temperatura di 64 °C.
Soluzione
Trasformiamo i dati:
Sottraendo alla massa finale dell’acqua la massa inizialmente contenuta nel calorimetro determiniamo il quantitativo di vapore condensato:
Osserviamo, quindi, che il sistema descritto nel testo dell’esercizio è aperto, in quanto la massa al suo interno è variata; per procedere nella soluzione sfruttiamo il 1° principio della termodinamica in forma entalpica.
Considerando che L = 0 e Q = 0 in quanto il calorimetro è termicamente isolato si ottiene:
cioè:
L’entalpia finale dipende solamente dal contributo dell’acqua presente nel calorimetro al termine del processo, pertanto:
dove CL è il calore specifico dell’acqua e vale 4.187 kJ/kg °C.
Allo stato finale avremo:
mentre per il vapore si avrà:
dove hVAP è l’entalpia specifica del vapore, r è chiamato "vapore latente di vaporizzazione" (analogo all’entalpia differenziale hd nella tabella A), hliq è l’entalpia specifica dell’acqua (quarta colonna nella tabella A) e x è il titolo del vapore che rappresenta la nostra incognita.
Sostituendo nella (21) i valori ricavati dalla tabella A a pagina 11 in corrispondenza della temperatura t = 100 °C, otteniamo:
Ponendo in (18) i risultati ottenuti nella (19), nella (20) e nella (22), si ottiene un’equazione nell’incognita x:
dalla quale, risolvendo, si determina: