CICLI FRIGORIFERI

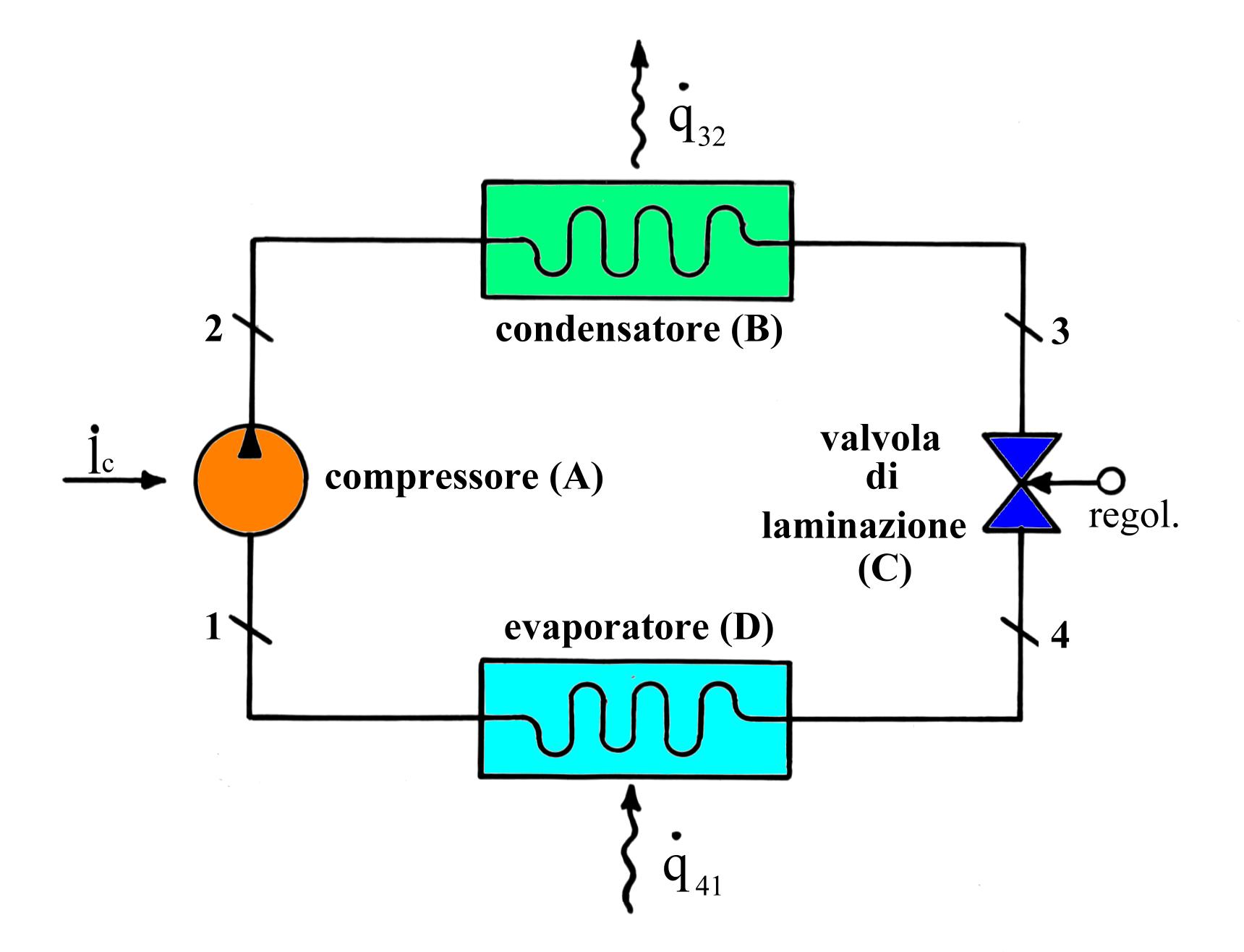
Fig.1 - Schema di impianto frigorifero a ciclo inverso a compressione-espansione
Esso si costituisce essenzialmente di :
elettrico ; (A)
Il circuito è percorso da un fluido frigorifero.
Tra i più utilizzati negli impianti di modeste dimensioni citiamo il FREON 11 , FREON 12 e il FREON 22 che rientrano nella categoria dei CloroFluoroCarburi (CFC) ; queste sostanze contengono cloro e rilasciate nell’atmosfera attaccano lo strato d’ozono che circonda la terra , perciò sono allo studio composti a minor impatto ambientale .
Altra sostanza molto usata negli impianti di una certa entità è l’ammoniaca che presenta buone caratteristiche termodinamiche .
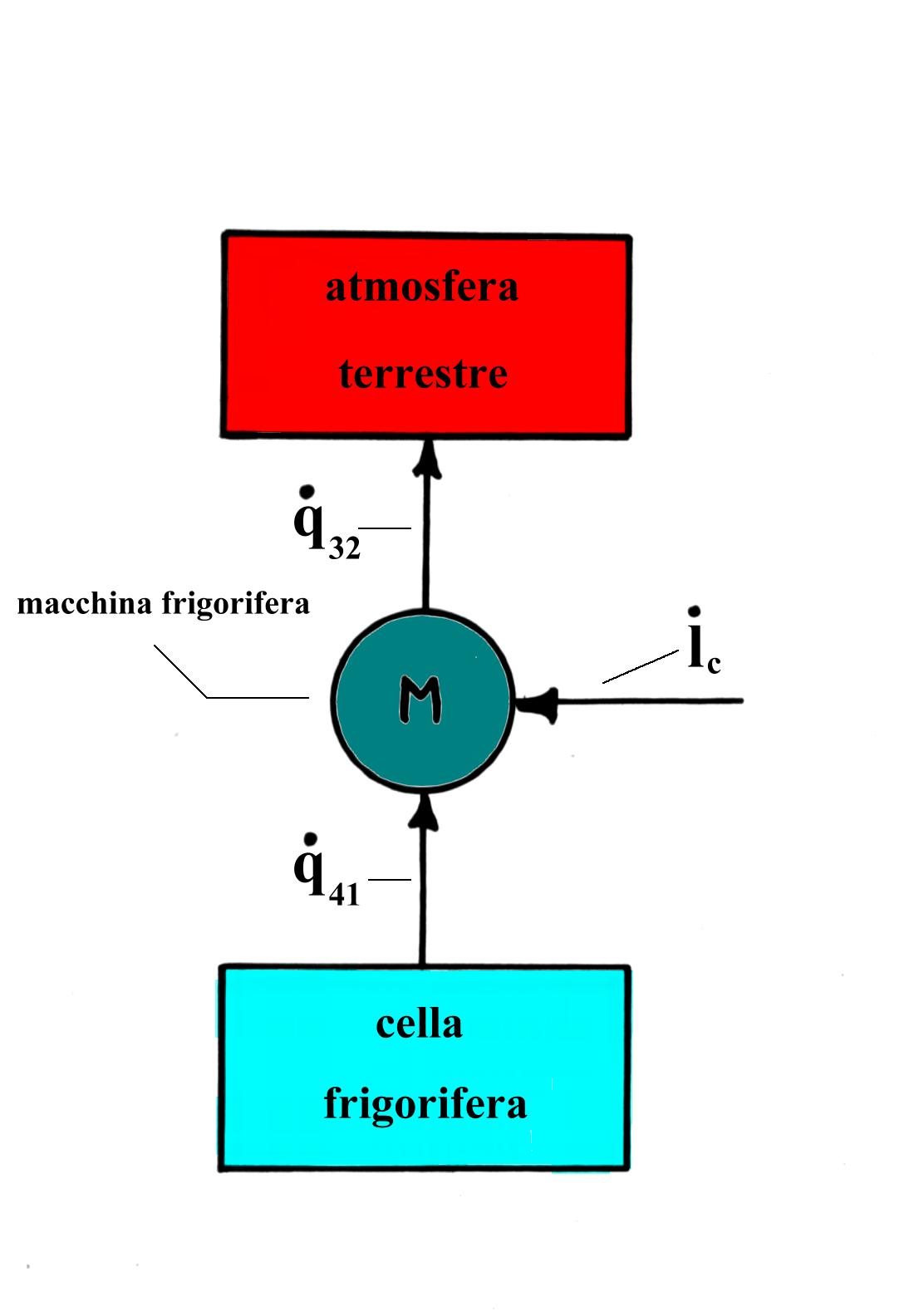 Possiamo dare una rappresentazione teorica schematica dei flussi di energia termica in gioco in questo processo. Consideriamo l’atmosfera terrestre e la cella refrigerata come serbatoi di calore, cioè sistemi dai quali può essere prelevata o ai quali può essere ceduta qualsiasi quantità di energia termica senza che possa variare la relativa temperatura. Questo è in particolare il caso della macchina teorica di Carnot.
Possiamo dare una rappresentazione teorica schematica dei flussi di energia termica in gioco in questo processo. Consideriamo l’atmosfera terrestre e la cella refrigerata come serbatoi di calore, cioè sistemi dai quali può essere prelevata o ai quali può essere ceduta qualsiasi quantità di energia termica senza che possa variare la relativa temperatura. Questo è in particolare il caso della macchina teorica di Carnot.
Fig.2 Schema a blocchi generico di una macchina che compie trasformazioni termodinamiche
Occupiamoci adesso delle trasformazioni del fluido. Possiamo fornire diversi andamenti di alcune grandezze specifiche in funzione di altre.
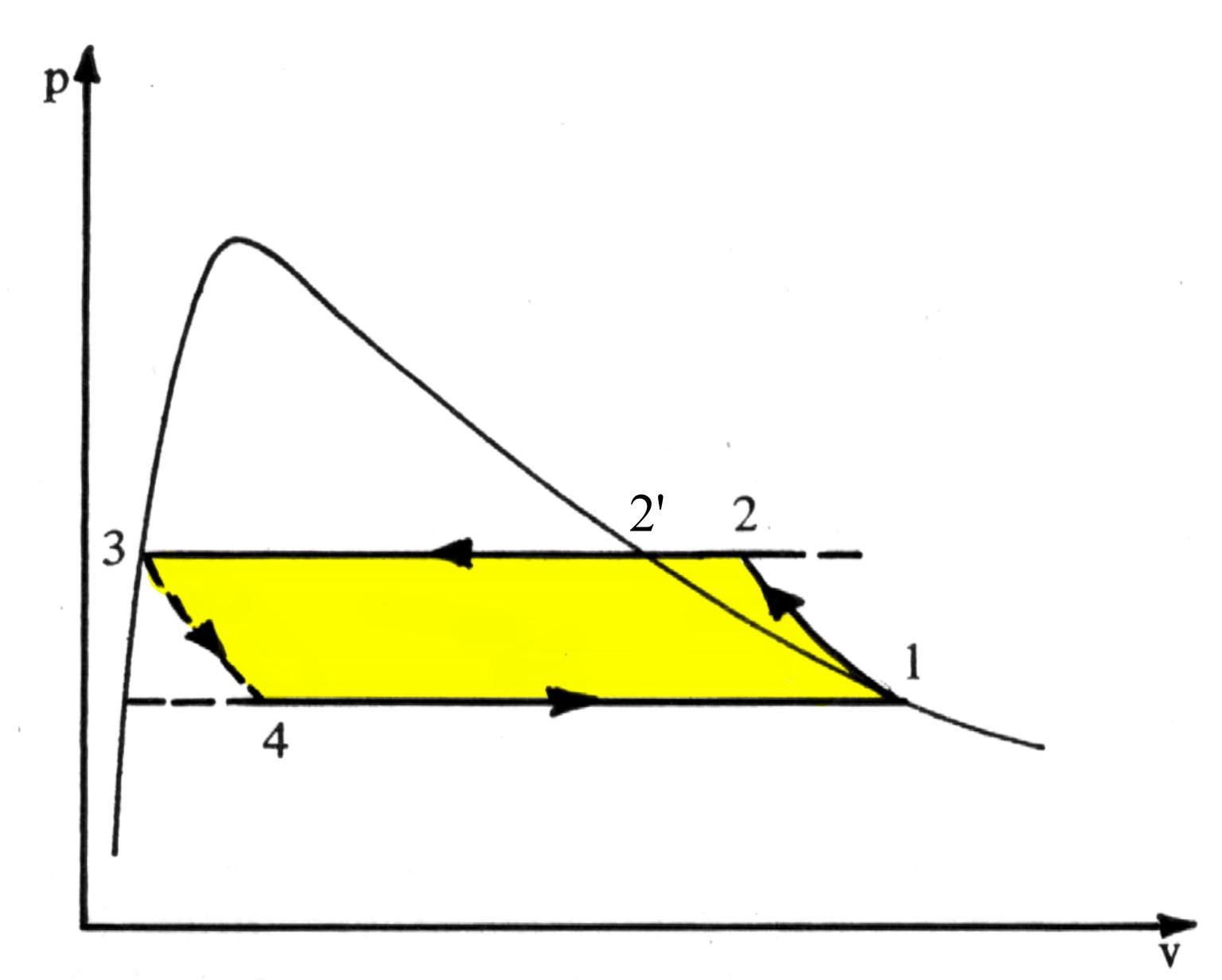 Vediamo una rappresentazione nel piano p-v.
Vediamo una rappresentazione nel piano p-v.
Fig.3. Il ciclo frigorifero nel diagramma p-v
È immediato riconoscere una somiglianza tra questo ciclo e quello di Rankine con surriscaldamento : il ciclo frigorifero si svolge nel campo dei vapori surriscaldati e nel campo del vapore saturo , mentre il ciclo Rankine diretto occupa anche una regione del liquido al di fuori della relativa curva limite. Inoltre qui la pompa del liquido è sostituita dalla valvola di laminazione e il ciclo viene percorso in senso inverso.
Nei componenti del circuito il fluido subisce delle trasformazioni termodinamiche perciò lo troveremo nei punti contrassegnati con 1 , 2 ,2’, 3 , 4 dei diagrammi con diversi valori delle grandezze p , V , T .
Inoltre nella trattazione ammettiamo che tutte queste trasformazioni avvengano per stati di equilibrio. In realtà questo non avviene, occorre infatti tenere conto che alcuni processi sono irreversibili: il nostro studio si concentra su una situazione teorica , perciò non riproducibile fisicamente. Nel suo insieme il ciclo è un sistema chiuso: per analizzarlo lo suddividiamo in 4 sistemi aperti successivi.
Nella sezione 1 il fluido arriva dalla cella frigorifera come gas (vapore saturo secco)a bassa pressione. Esso subisce una compressione (A) adiabatica e reversibile (trasf. 1® 2) , perciò lo troviamo ad alta pressione e fortemente riscaldato nel punto (B).
Il fluido percorre la serpentina cedendo la quantità (per unità di massa e di tempo) di calore q (3,2) all’ambiente, per cui si raffredda e condensa a pressione costante. Siccome il punto 2 è fuori dalle curve limite, le fasi di raffreddamento e di condensazione sono ben distinte: infatti il tratto 2® 2’ rappresenta la fase di raffreddamento che avviene nel campo del vapore surriscaldato, mentre la 2® 3 quella di condensazione in cui varia il titolo della miscela liquido-vapore tra 1 e 0 e la temperatura si mantiene costante.
Dopodiché il fluido attraversa la valvola di laminazione (C) dove avviene una diminuzione di pressione e temperatura mentre viene conservata l’entalpia.
Il fluido percorre la serpentina all’interno della cella sottraendo ad essa la quantità di calore (per unità di massa e di tempo) q (4® 1) : di conseguenza vaporizza a pressione costante e ritorna nel compressore. A rigore la trasformazione 3® 4 dovrebbe avvenire all’interno di una turbina, dove l’espansione sarebbe sfruttata per produrre lavoro utile. Tuttavia la quantità di lavoro ricavata sarebbe modesta se confrontata con quella spesa per la compressione del fluido, perciò si preferisce rinunciare a recuperare tale lavoro a vantaggio di una maggior semplicità costruttiva.
Uno svantaggio nell’uso della valvola di strozzamento è rappresentato dalla forte irreversibilità del processo che in essa avviene (tratteggio nei diagrammi):
la dispersione dell’energia utile non recuperata fa si che nel diagramma p-v il punto 4 sia spostato verso volumi maggiori rispetto alla posizione che si avrebbe in presenza della turbina.
Questo fatto è evidenziato anche nei diagrammi T-s , h-s che riportiamo :
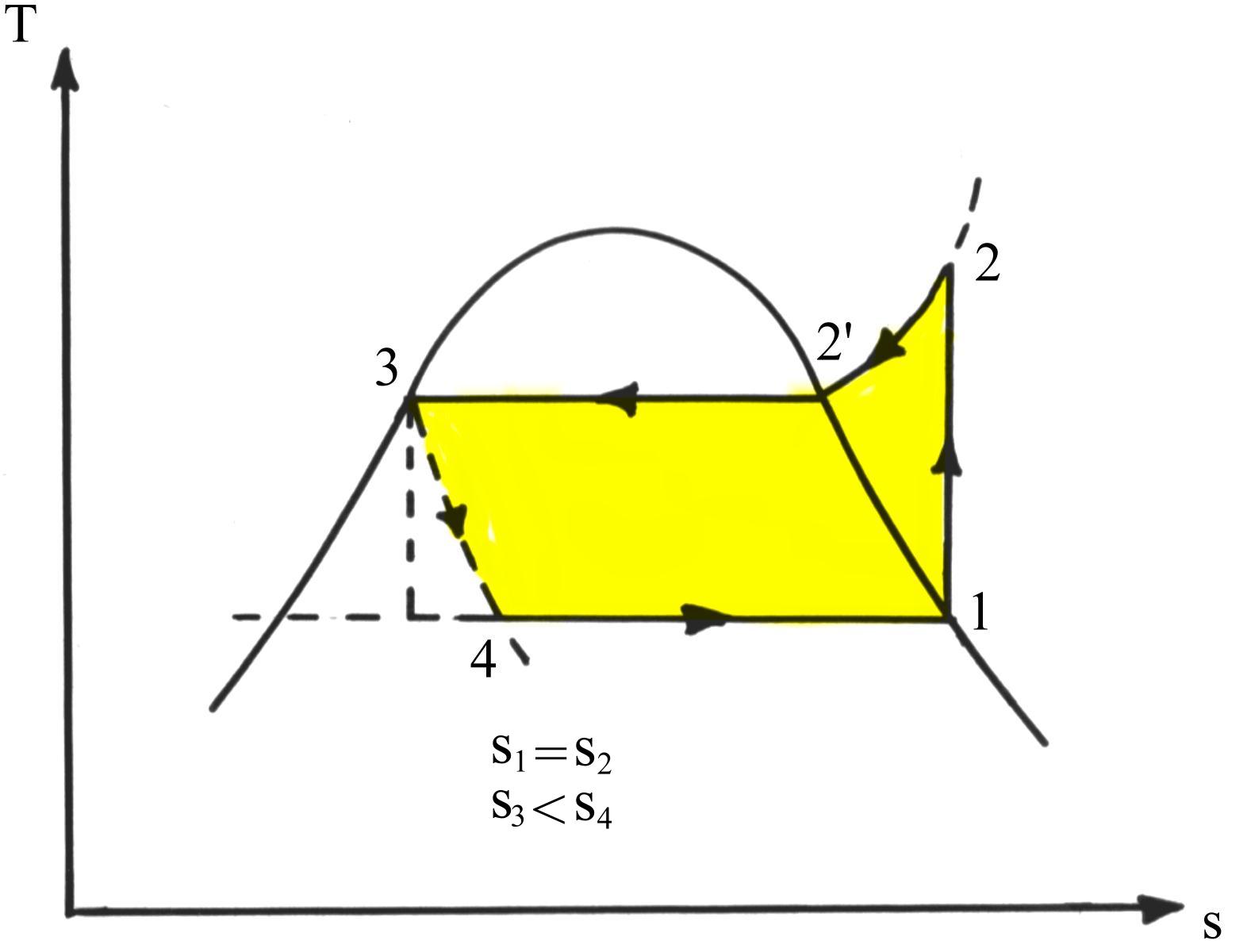 Fig.4 Il ciclo frigorifero nel diagramma T-s
Fig.4 Il ciclo frigorifero nel diagramma T-s
Il tratto verticale 1® 2 rappresenta la fase di compressione reversibile che supponiamo avvenire in assenza di scambi di calore tra fluido e pareti del compressore. Il tratteggio 3® 4 evidenzia l’irreversibilità del processo reale di laminazione.
Inoltre sono evidenziati i processi che avvengono a temperatura costante, vale a dire quello di condensazione 2’® 3 e di evaporazione 4® 1.
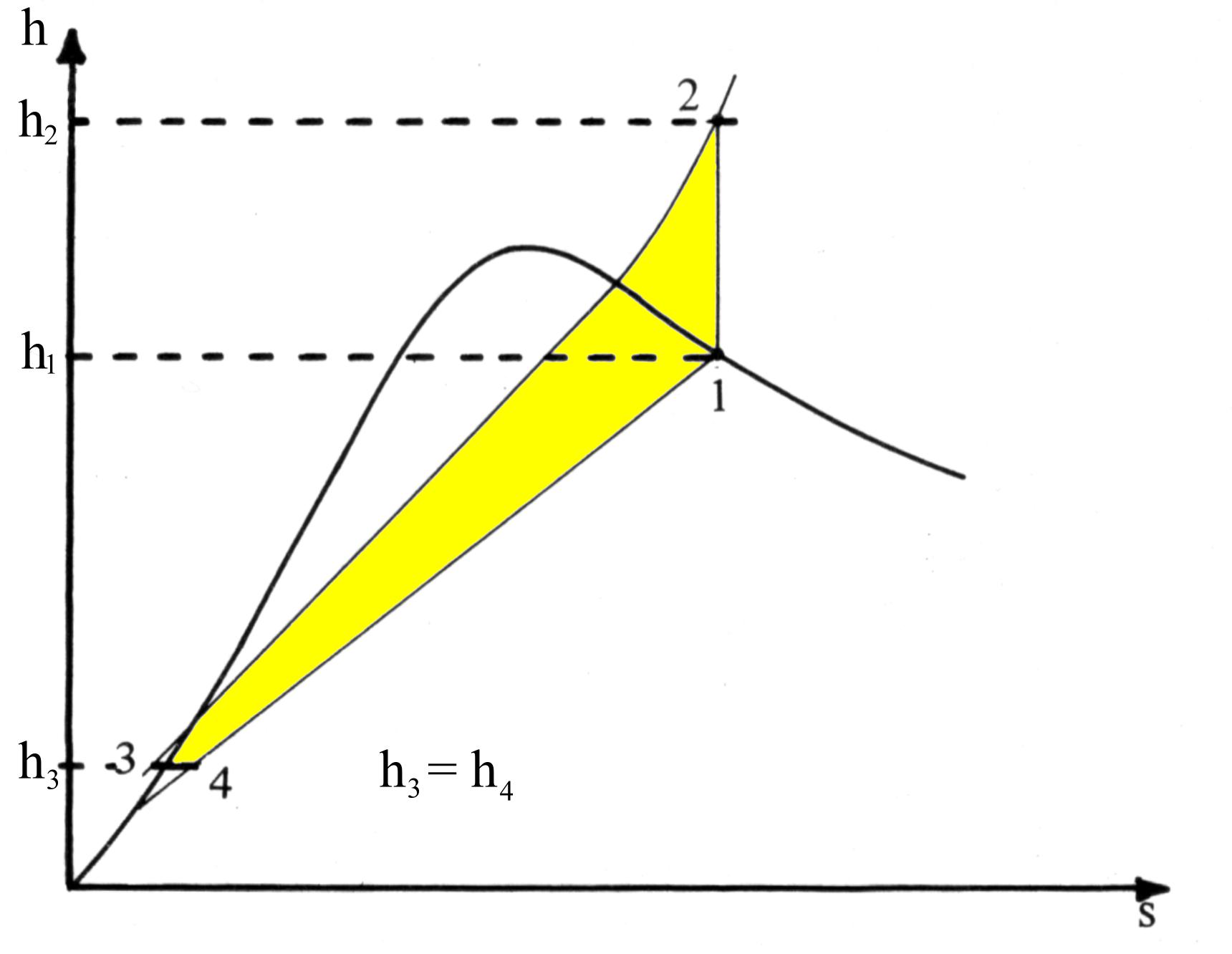
Fig.5 Il ciclo frigorifero nel diagramma h-s
Nel diagramma di fig.5 sono invece evidenziate la trasformazione 1® 2 a entalpia specifica costante (compressione) e quella a entropia specifica costante 3® 4 (laminazione).
Inoltre, i luoghi dei punti a pressione costante sono delle rette nel campo del vapore saturo con pendenza pari alla temperatura assoluta, mentre nel campo del vapore surriscaldato sono curve a pendenza crescente (secondo l’asse s) ancora pari alla temperatura stessa.
Un’altra curva significativa è il diagramma di Mollier, o curva p-h : si possono direttamente leggere i valori di entalpia specifica. Inoltre questo è importante in fase di taratura della macchina in quanto le caratteristiche del fluido usato sono 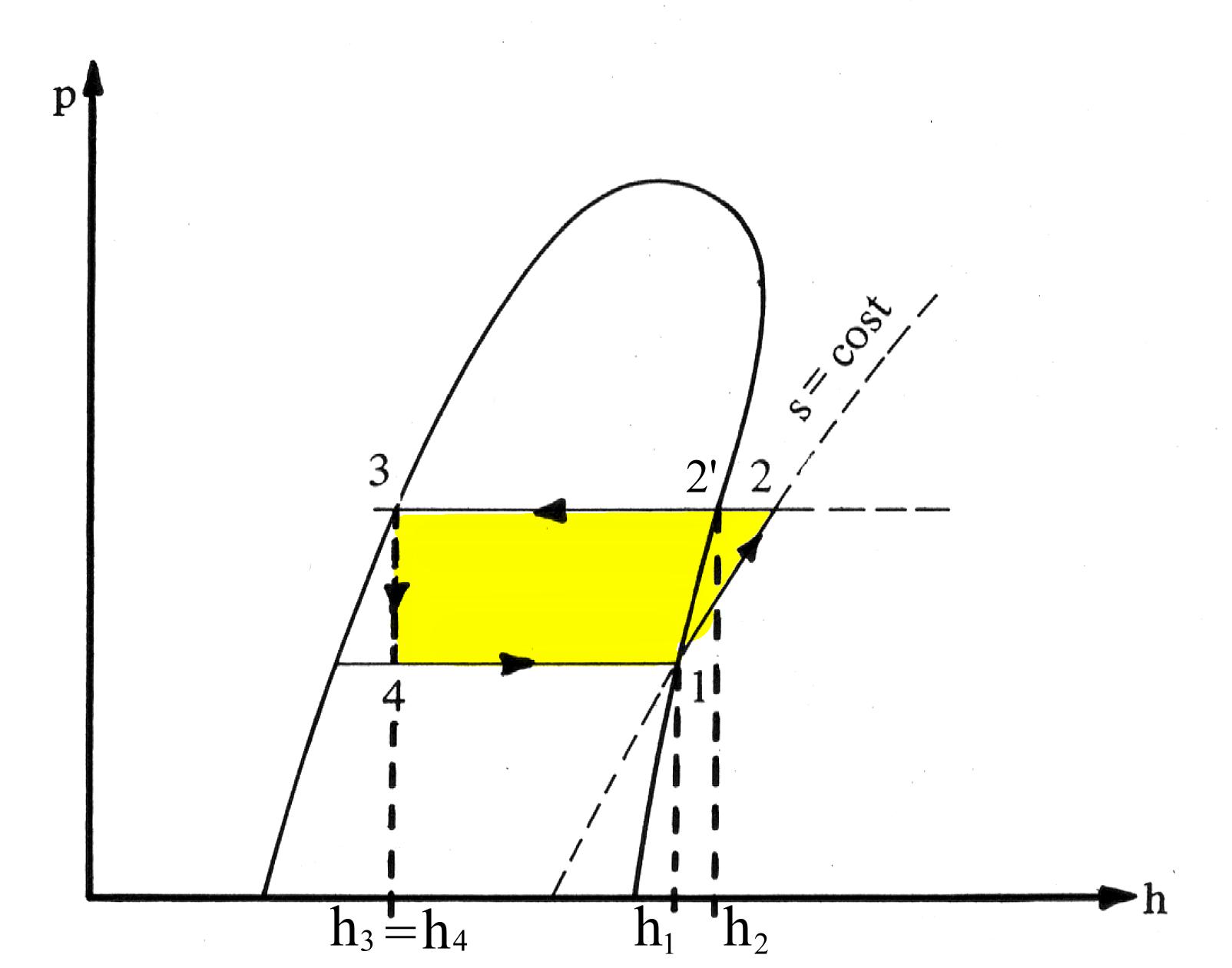 solitamente espresse in termini di pressione-entalpia a temperature assegnate.
solitamente espresse in termini di pressione-entalpia a temperature assegnate.
Fig.6 Rappresentazione del ciclo nel diagramma p-h
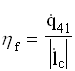 La grandezza termodinamica che misura il rendimento della macchina è il coefficiente di effetto utile frigorifero, definito come rapporto tra calore assorbito dalla cella e lavoro richiesto dal compressore( grandezze riferite ad unità di massa e di tempo):
La grandezza termodinamica che misura il rendimento della macchina è il coefficiente di effetto utile frigorifero, definito come rapporto tra calore assorbito dalla cella e lavoro richiesto dal compressore( grandezze riferite ad unità di massa e di tempo):
![]()
![]() Avendo considerato il ciclo come successione di sistemi aperti, vale:
Avendo considerato il ciclo come successione di sistemi aperti, vale:
![]()
![]()
![]()
![]()
Applicando il bilancio dell’energia alla macchina :
![]()
![]()
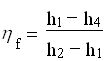 Infine combinando le (1),(2),(3),(4) avremo:
Infine combinando le (1),(2),(3),(4) avremo:
![]()
La macchina frigorifera può funzionare anche come pompa di calore: essa preleva calore dall’ambiente esterno (atmosfera) freddo e ne cede ad una regione (come ad esempio le stanze di un’abitazione) a temperatura maggiore per riscaldarla.
Dal punto di vista termodinamico la stessa macchina presenta un maggior rendimento se utilizzata come pompa anziché come frigorifero: la quantità di calore erogata all’ambiente da riscaldare come pompa di calore è sempre maggiore (del lavoro di compressione) della quantità prelevata dalla cella come frigorifero.
![]()
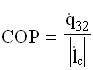 Analogamente a quanto già visto, si definisce un coefficiente di prestazione della pompa di calore:
Analogamente a quanto già visto, si definisce un coefficiente di prestazione della pompa di calore:
Essendo:
![]()
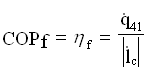
![]() Combinando le espressioni (6),(7) avremo l’espressione:
Combinando le espressioni (6),(7) avremo l’espressione:
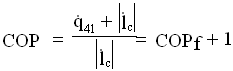
ESEMPIO.
Una macchina frigorifera utilizza come fluido refrigerante Freon 12. Conoscendo la potenza della macchina e le temperature estreme di funzionamento, determinare:
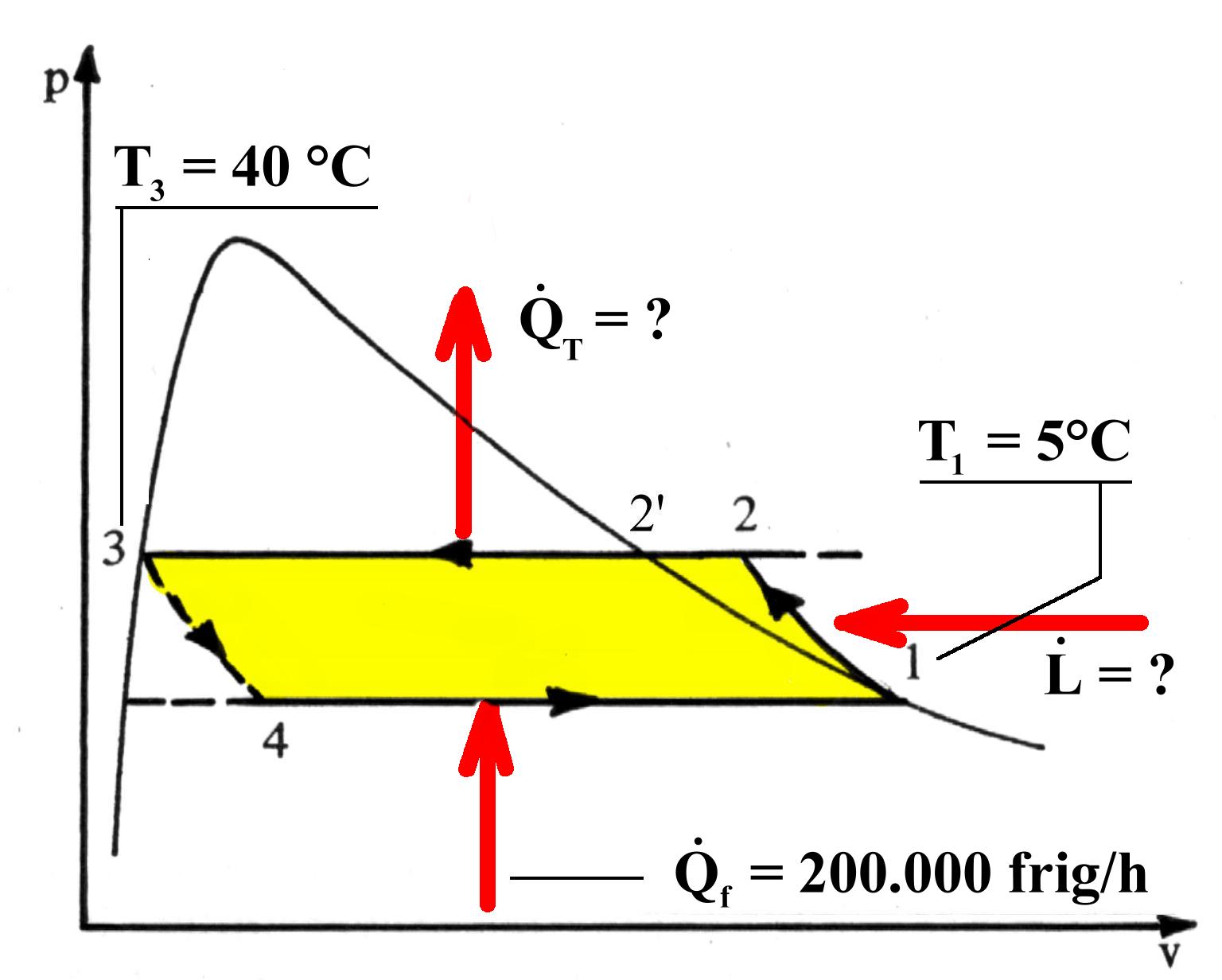 La potenza meccanica assorbita dal compressore e la potenza termica della pompa di calore.
La potenza meccanica assorbita dal compressore e la potenza termica della pompa di calore.Fig.7. Il diagramma p-v dell’esercizio.
![]()
![]()
![]() I dati sono i seguenti:
I dati sono i seguenti:
|
Punto nel grafico p-v |
Pressione (Bar) |
Temperatura (gr. centigradi) |
Entalpia specifica ( kJ / kg) |
|
1 |
3,6 |
5 |
353,611 |
|
2 |
9,6 |
50 |
371,070 |
|
3 |
9,6 |
40 |
238,526 |
|
4 |
3,6 |
5 |
238,526 |
![]() Il coefficiente di effetto utile vale:
Il coefficiente di effetto utile vale:
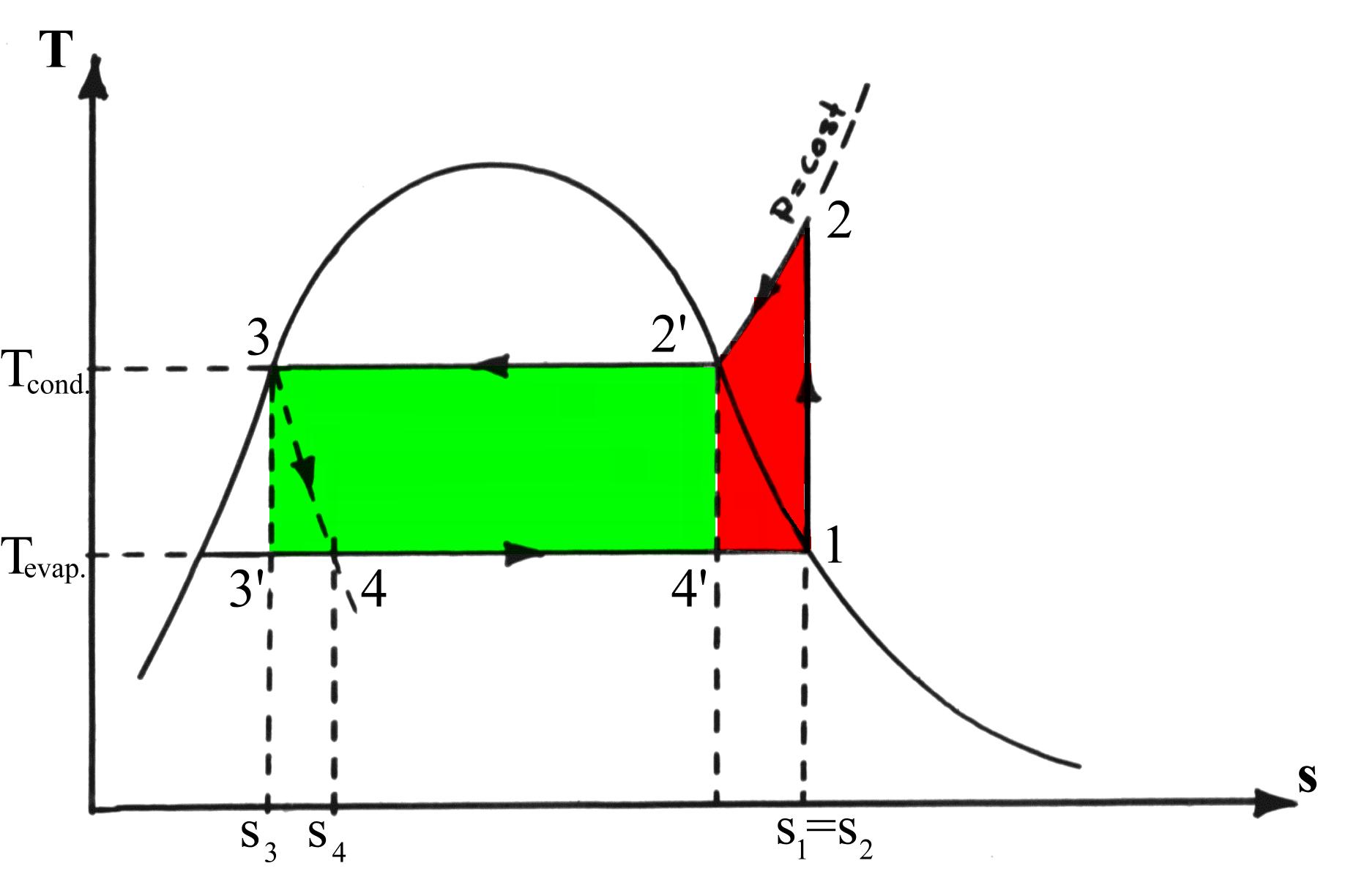 Per ricavare un dato veramente significativo della resa della macchina dovremo rapportare il coefficiente trovato con quello di una macchina frigorifera basata sul ciclo di Carnot inverso operante tra due serbatoi di calore alle temperature di 5 e 40 gradi centigradi. Questo perché il coefficiente di effetto utile risulta massimo per un ciclo teorico di Carnot inverso.
Per ricavare un dato veramente significativo della resa della macchina dovremo rapportare il coefficiente trovato con quello di una macchina frigorifera basata sul ciclo di Carnot inverso operante tra due serbatoi di calore alle temperature di 5 e 40 gradi centigradi. Questo perché il coefficiente di effetto utile risulta massimo per un ciclo teorico di Carnot inverso.
Questa situazione si può chiarire sul diagramma di figura 8.
Fig. 8. Confronto tra i cicli inversi di Carnot (verde) e di Rankine.
Dall’equazione per i sistemi reversibili dq = Tds , si deduce che l’area racchiusa da un generico ciclo chiuso è una quantità d’energia specifica. In particolare percorrendo interamente il ciclo si ha che detta quantità corrisponde (in valore assoluto) alla differenza tra l’energia che il sistema cede all’ambiente e quella che riceve dalla cella, pari cioè al lavoro di compressione (se si trascura la perdita nella valvola). Dal diagramma si nota che l’area racchiusa dal ciclo Carnot risulta minore di quella relativa al ciclo Rankine( differenza delle aree in rosso) : ciò è dovuto ad un surriscaldamento aggiuntivo voluto nel ciclo reale. Infatti, con questo accorgimento si limita di fatto la capacità refrigerante della macchina, ma in compenso si evitano danni al compressore eventualmente dovuti alla presenza di particelle di liquido che urtano le sue parti in moto. Inoltre il ciclo di Carnot ( in verde) risulta irrealizzabile, vista l’impossibilità di avere sorgenti di energia a temperatura costante.
Per il ciclo Carnot definiamo il coefficiente di effetto utile come:
![]()
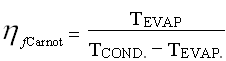
che risulta:
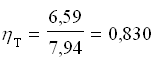
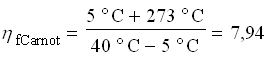 Perciò il rendimento termodinamico del frigorifero vale:
Perciò il rendimento termodinamico del frigorifero vale:
Se l’impianto viene usato da pompa di calore, avremo:
![]()
![]() Infine, dalla definizione, la potenza del compressore (teorica) è:
Infine, dalla definizione, la potenza del compressore (teorica) è:
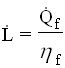
E per il principio di conservazione dell’energia, si trova la potenza termica fornita:
![]()
![]()
Essendo 1 frig = 1 kcal in valore assoluto , 1cal = 4,187 J , 1h = 3.600 s ,
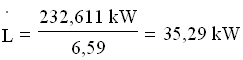
![]() si ha: 200.000 frig/h = 200.000 x 4,187 kJ / 3.600 s = 232,611 kW, da cui:
si ha: 200.000 frig/h = 200.000 x 4,187 kJ / 3.600 s = 232,611 kW, da cui:
mentre la potenza termica fornita all’abitazione:
![]()
![]()
------------------------------------------------------------------------------------------------------
MISCELE DI GAS PERFETTI - LEGGE DI DALTON
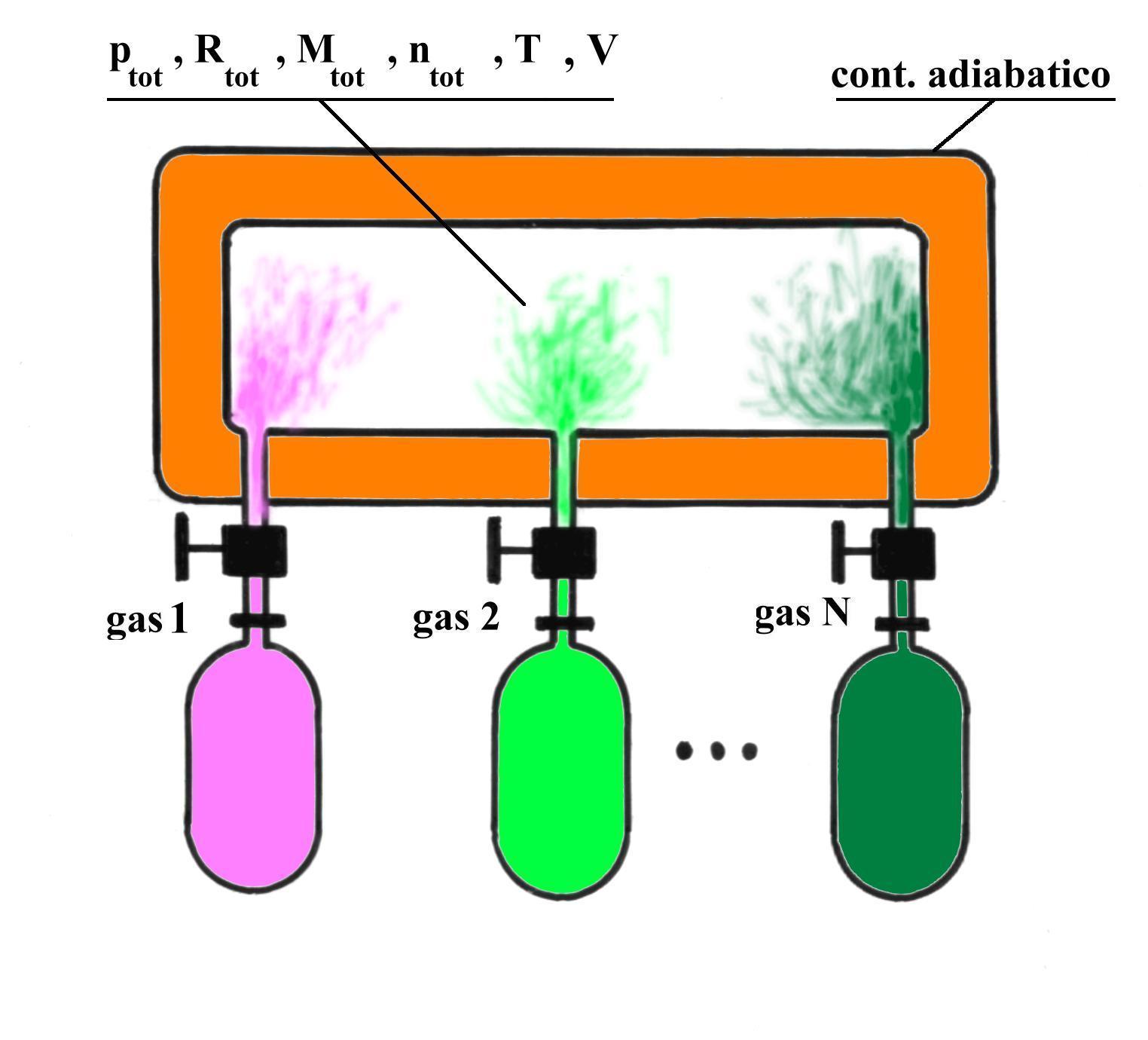
Fig.9 Miscelazione di gas perfetti.
Indichiamo con N il numero di gas costituenti la miscela e con n![]() e M
e M![]() rispettivamente il numero di moli e la massa dell’ i-esimo gas, per i = 1.. N.
rispettivamente il numero di moli e la massa dell’ i-esimo gas, per i = 1.. N.
Per questo sistema vale la Legge di Dalton :
![]()
![]()
dove la quantità ![]() è detta pressione parziale; con ciò intendiamo la pressione esercitata dal gas i- esimo occupante tutto il volume V disponibile, in assenza degli altri componenti .
è detta pressione parziale; con ciò intendiamo la pressione esercitata dal gas i- esimo occupante tutto il volume V disponibile, in assenza degli altri componenti .
Consideriamo adesso l’equazione per i gas perfetti
![]()
![]()
dove:
R![]() è la costante tipica del gas perfetto in esame;
è la costante tipica del gas perfetto in esame;
M è la massa del gas espressa in g o in kg;
T la temperatura assoluta;
p la sua pressione in Pascal e V il suo volume in metri cubi;
formulando l’espressione (2) per gli N gas:
![]()
![]() . .
. .
![]() . .
. .
![]()
![]() Sommando membro a membro la (3) e raccogliendo V e T a fattor comune si ottiene:
Sommando membro a membro la (3) e raccogliendo V e T a fattor comune si ottiene:
![]()
![]()
Per la miscela vale ancora la legge dei gas perfetti (2), essendone questa costituita:
![]()
![]()
![]() A questo punto, confrontando le ultime due espressioni e applicando la legge di Dalton, possiamo ricavare l’espressione di R per la miscela :
A questo punto, confrontando le ultime due espressioni e applicando la legge di Dalton, possiamo ricavare l’espressione di R per la miscela :
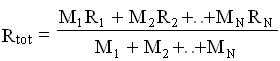
Questo risultato può essere così espresso: il coefficiente R![]() di una miscela di N gas perfetti è la media pesata dei coefficienti relativi ai singoli gas componenti.
di una miscela di N gas perfetti è la media pesata dei coefficienti relativi ai singoli gas componenti.
Analogamente possiamo operare considerando il numero di moli anziché le masse:
![]()
![]()
![]() . .
. .
![]() . .
. .
Sommando ancora le equazioni (7) membro a membro otteniamo:
![]()
![]()
e procedendo come poc’anzi, si ottiene:
![]()
![]()
Perciò operando con il numero di moli, la trattazione termodinamica della miscela è semplice.
Un’altra conseguenza della legge di Dalton è la seguente:
![]()
![]() per l’i-esimo gas:
per l’i-esimo gas:
per la miscela:
![]()
![]()
![]() Eseguendo il rapporto membro a membro delle due espressioni(10) e (11) si ottiene:
Eseguendo il rapporto membro a membro delle due espressioni(10) e (11) si ottiene:
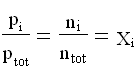
( frazione molare dell’i-esimo componente anche detta percentuale in volume)
![]()
![]() Perciò
Perciò
la pressione parziale esercitata da un gas si ottiene dal prodotto della pressione della miscela per la frazione molare di quel gas.
![]()
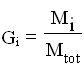 Analogamente definiamo la frazione massica come:
Analogamente definiamo la frazione massica come:
detta anche percentuale in peso.
ESEMPIO : l’aria .
Calcolare le pressioni parziali di O![]() e di N
e di N![]() , sapendo che le loro frazioni molari sono rispettivamente 0,20 e 0,80 ; calcolare le frazioni massiche dei due componenti.
, sapendo che le loro frazioni molari sono rispettivamente 0,20 e 0,80 ; calcolare le frazioni massiche dei due componenti.
![]() Avendo:
Avendo:
![]()
![]()
Per semplicità riferiamoci ad una mole di aria:
![]()
![]()
![]()
Perciò:
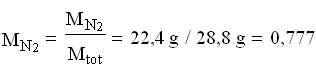
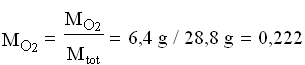
Si può notare che le frazioni massiche differiscono dalle rispettive frazioni molari.
ESERCIZIO
Uno scatolone adiabatico contiene ossigeno e azoto separati da un setto ancora adiabatico. I due gas si trovano alla stessa pressione e alla stessa temperatura e si possono trattare come gas perfetti. Togliendo il setto avviene la miscelazione e si produce aria "sintetica".
Trovare: - la massa finale della miscela;
- la variazione di entropia D S.
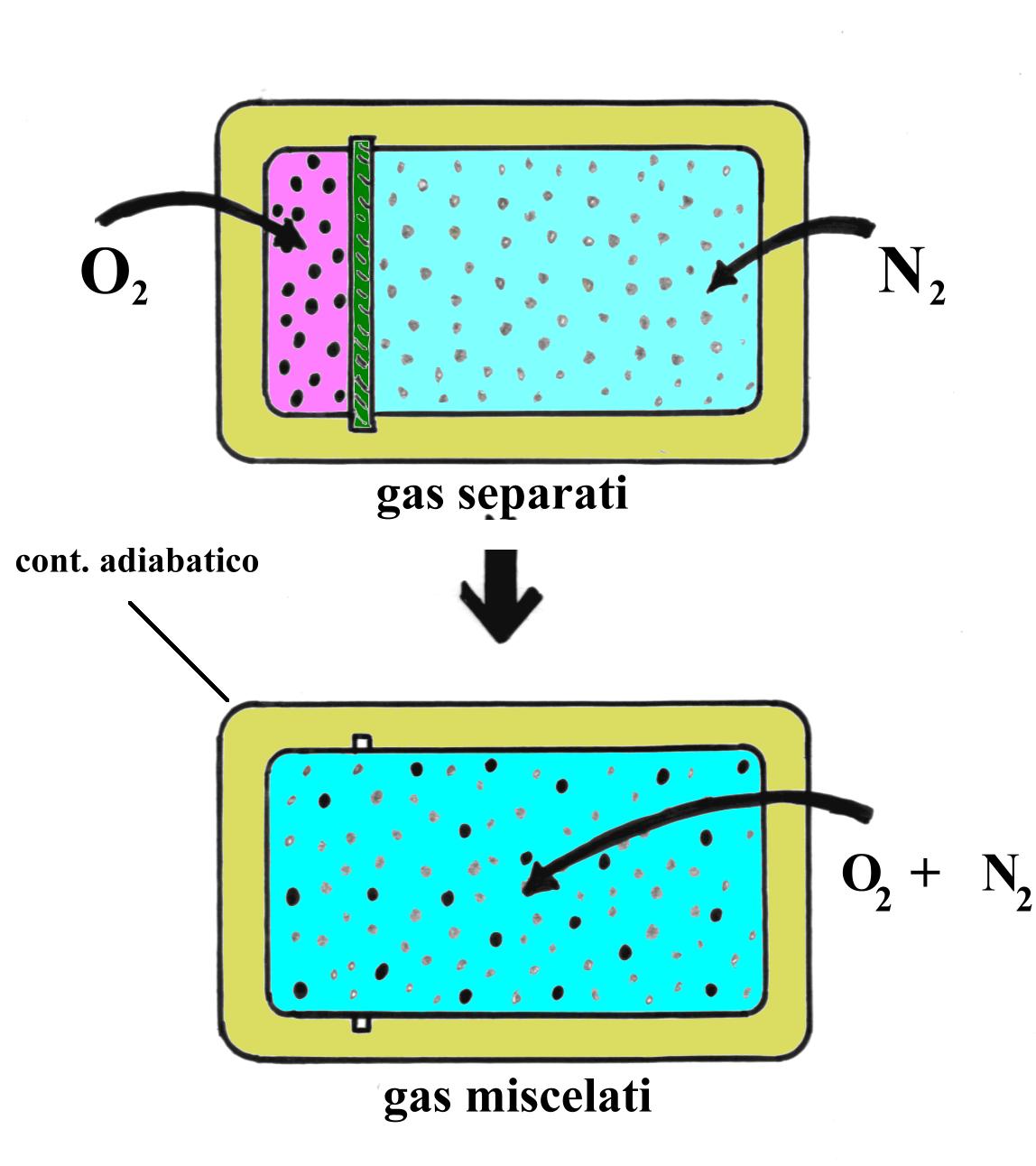
Fig.10- Togliendo il setto i gas si mescolano.
I dati in nostro possesso sono riassunti nella seguente tabella:
|
Pressione (Bar) |
Volume (metri cubi) |
Temperatura (gr. Cent.) |
|
|
OSSIGENO |
1 |
0,21 |
20 |
|
AZOTO |
1 |
0,79 |
20 |
Essendo il sistema isolato, non scambia calore con il mondo esterno e non viene prodotto lavoro (e neanche assorbito) dunque Q = 0 , L = 0 .
Nonostante ciò, si verifica un aumento d’entropia.
Le grandezze che caratterizzano il sistema alla fine del processo le indichiamo con l’apice "3". Per quanto detto, si intuisce che la temperatura finale deve essere per forza pari a 20°C , essendo questa la temperatura di entrambi i gas all’inizio del processo, che avviene in modo adiabatico.
![]() Dunque:
Dunque:
![]() Inoltre i volumi si sommano:
Inoltre i volumi si sommano:
Per trovare la massa della miscela finale, ricaviamo le costanti dei gas poi applichiamo l’equazione dei gas perfetti.
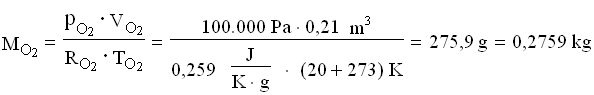
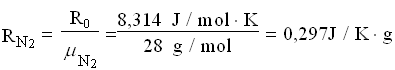
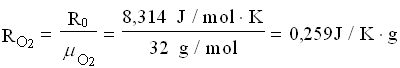
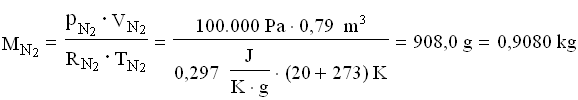 A questo punto le masse si sommano:
A questo punto le masse si sommano:
![]() Per calcolare il salto di entropia , occorre sommare i salti relativi ai singoli gas tra lo stato finale e quello iniziale:
Per calcolare il salto di entropia , occorre sommare i salti relativi ai singoli gas tra lo stato finale e quello iniziale:
![]()
dove:
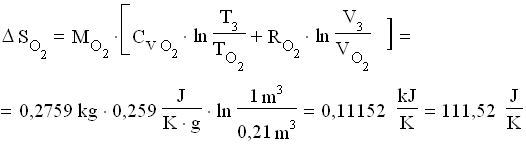
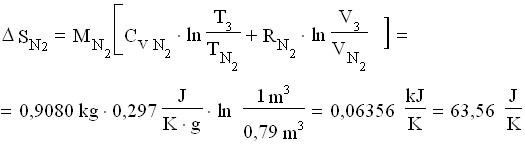
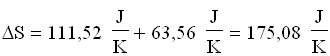 Perciò:
Perciò:
Come si può notare, il processo di miscelazione comporta aumento di entropia.
------------------------------------------------------------------------------------------------------