Obbiettivo raggiungere gli 0 K
Temperature dell’ordine dei 2 ¸ 3 K erano richieste
per eseguire esperimenti riguardanti la superconduttività prima della scoperta dei
cosiddetti superconduttori a temperatura elevata e sono tuttora impiegate nello
studio del confinamento dei plasmi .
ESERCIZIO
Si vuole asportare da un serbatoio alla temperatura TMIN un certa quantità di calore Q2 tramite una macchina frigorifera semplice
Vogliamo sapere quale è il costo per estrarre dal serbatoio alla temperatura TMIN = 0,001K la quantità di calore Q2 pari ad 1 kJ
IL COSTO ENERGETICO CEN E’
Risoluzione......
Calcoleremo il costo MINIMO tramite l’uso della macchina di Carnot. Chiaramente il costo REALE sarà sensibilmente più alto poiché le macchine reali non sono di Carnot.
Sappiamo che il Coefficiente Economico emax è dato da
NOTA BENE :
Il numero tra parentesi è molto piccolo, ma in questo caso è IMPORTANTE NON APPROSSIMARE altrimenti viene perso tutto il senso fisico del risultato
Per il primo principio, poiché non c’è stata variazione di energia interna,
Essendo
Q2 = 1 kJ
sostituendo ricavo L
à L = 1 kJ × 292'999,0243 = 293'000 kJ
Il costo energetico CEN è riportato in £ / (kWh) e dobbiamo convertirlo in £ / kJ per essere coerenti con Sistema Internazionale
1 kW/h = 3600 kJ
Il costo totale CTOT richiesto per estrarre la quantità di calore Q2 è
CTOT = CEN × L
à CTOT = 293'000 × 0,4167 = 12'208 £
PROBLEMI DI LAVORO MASSIMO
Sono una tipologia di problemi in cui viene richiesto, dato un certo sistema, di stabilire quale sia il massimo lavoro ottenibile dal sistema stesso.
Risolveremo un esercizio in due metodi diversi. Il primo metodo è fatto
ad hoc per il problema dato, il secondo invece è del tutto generale e si avvale di alcune
considerazioni derivanti dal secondo principio della termodinamica.
ESERCIZIO
Quale è il massimo lavoro ottenibile da 1 m3 di H2O inizialmente alla temperatura T1=100°C e mantenuta a V costante ?. Si supponga To=20°C
Consideriamo una macchina termica collegata al serbatoio
La macchina non può essere SEMPLICE dato che la temperatura del serbatoio non è costante.
Quindi NON E’ LA MACCHINA DI CARNOT A FORNIRE IL MASSIMO LAVORO.
METODO 1
La trasformazione avviene a V = cost per qui il calore scambiato dal serbatoio sarà
dQ = CvdT , cioè una retta nel piano (T,Q) .
La macchina potrà funzionare fintanto che la temperatura dell’H2O nel serbatoio è maggiore di T0 (altrimenti violiamo il principio 0 della termodinamica) .
Ci si accorge subito, guardando il grafico, che prendendo due temperature di funzionamento TC e T0 FISSE , si ha un calore scambiato QC ben inferiore al massimo calore scambiato disponibile QMAX.
Inoltre, poiché
si vede che il lavoro svolto non è quello massimo e buona parte dell’energia disponibile non viene convertita in lavoro.
Si può realizzare il lavoro massimo tramite una macchina che NON LAVORA con due temperature fissate ma che segue caratteristica Q( T ) sul piano (T,Q )
Per fare ciò immaginiamo di prendere una serie di macchine termiche
reversibili,operanti in modo tale da asportare il calore dall’H2O alle
varie temperature scaricando verso il serbatoio alla temperatura To una
quantità di calore dQ infinitesima.
Il lavoro dlMAX per unità di massa è
Integrando tra le temperature T1 e T0
Il calore specifico dell’H2O è
CV = 4,187
Sostituendo i dati in (1) ricavo
lMAX = 4,187·(100-20)·293· 4,187 ln (373/293) =38,806 kJ/kg
Infine il lavoro LMAX ottenuto da 1 m3 di H2O è
LMAX = lMAX ×MH2O (2)
La densità dell’H2O è
rH2O = 1000 kg/m3 è MH2O = 1000 kg
sostituendo in (2)
LMAX = 38,806 × 1000 = 38’806 kJ
Calcoliamo anche il Coefficiente Economico emax di questa macchina .
La quantità di calore QMAX che può essere trasformata in lavoro è data dall’area sottesa dal grafico cioè
QMAX = CV(T1-T0) = 4.187× (100-20) = 334,960 kJ = ETOT
da cui si ricava un coefficiente economico emax pari a
Il lavoro LMAX corrisponde alla quota di ETOT convertita in
EXERGIA . Tutta la restante parte è ANERGIA
METODO 2
Consideriamo l’universo costituito dal nostro sistema.
Per il teorema di Carnot il massimo lavoro si ha in corrispondenza di
DSu=0
La variazione di entropia è data dalla variazione di 3 contributi
DSU= DSBIDONE+DSMACCHINA+DSSERBATOIO (1)
Il contributo derivante dalla macchina è nullo poiché ciclica e REVERSIBILE per cui
DSMACCHINA = 0
La variazione di entropia del serbatoio
Per il bidone possiamo scrivere
lungo un qualunque cammino reversibile
Essendo la trasformazione a V=COST à dQ = CVdT da cui segue
Mettendo insieme i risultati otteniamo
Ovviamente è la stessa espressione che abbiamo calcolato col metodo visto prima.
Moltiplicando poi per MH2O arriviamo allo stesso risultato
VALUTAZIONE DEL COSTO ENERGETICO PER IL RISCALDAMENTO
Vogliamo mantenere una casa alla temperatura di 20°C . Per fare ciò immettiamo nella casa una POTENZA 1=10000 W che è pari alla potenza che viene dispersa QD
Supponiamo inoltre che T0 dell’ambiente esterno sia -5°C
Abbiamo a disposizione due metodi per riscaldare la casa e vogliamo sapere quale dei
due è il più efficiente dal punto di vista economico
Sicuramente la più vantaggiosa è la seconda poiché
quindi mi serve tanta potenza quanta ne dissipo
à
PEL=Q1×e =10000×0.088334=853.24 W
Un bel risparmio !!!!
Non abbiamo però considerato che ci serve dell’energia elettrica per far funzionare la pompa di calore. Questa deve essere prodotta da qualcuno e quindi dobbiamo considerare la quantità di energia necessaria a produrre la PEL richiesta.
Supponiamo di produrre la potenza PEL necessaria tramite un macchina termica ciclica che lavora alle temperature T1=100°C e T0= -5°C
il coefficiente economico della macchina termica e2 è
A noi serve una potenza PEL = 853,24 W . Dobbiamo estrarre dal serbatoio una Q100 pari a
Q100 = e2·Pel=0,2815·853,24=3031 W
sicuramente superiore agli 853,24 W precendenti ma ancora inferiore a quella richiesta dalla resistenza elettrica
SFRUTTAMENTO INTELLIGENTE DELLE RISORSE
Un sistema molto efficiente ed atto ad uno sfruttamento intelligente delle risorse è quello che è stato fatto a BRESCIA . E’ stata costruita una centrale termo-elettrica il cui scopo primario è quello di produrre ACQUA CALDA per tutta la città.
In questo modo gli abitanti non hanno nessun bisogno di utilizzare preziosa EXERGIA prodotta dalla combustione del metano per scaldare l’H2O ed inoltre hanno anche un risparmio nel riscaldamento poiché l’H2O calda circola già nelle case e nei termosioni senza bisogno ( teoricamente ) di ulteriori mezzi per il riscaldamento.
Oltre a ciò la centrale produce energia elettrica che può essere venduta ad altri enti, se in quantità rilevante, oppure utilizzata per altri scopi all’interno della città .
Facciamo una schema e proviamo a vedere come si comporta questo sistema
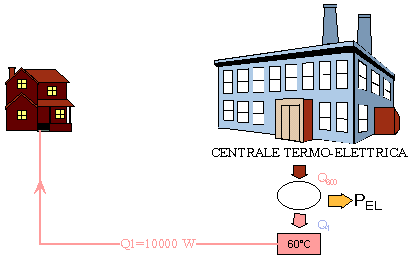
Supponiamo che l’H2O di scarto sia alla temperatura di 60°C e che la temperatura all’interno delle caldaie sia circa 600 °C.
Questo fa si che il coefficiente economico e3 della centrale sarà molto alto
Per comodità di scrittura indicheremo le poteze omettendo il puntino
La potenza ricavata dalla combustione sarà
Q600=PEL+Q600 dove Q100 è la potenza che mi serve per scaldare la casa
La PEL= e3·Q600 da cui ricaviamo che
Q600 = e3·Q600·Q100è Q600 = Q100/(1-e3) =10000/1-0,618 = 26178 W
per produrre 10000 W ne devo bruciare 26178 W . Sembra poco efficiente ma non ho considerato che questi 10000 sono ANERGIA e che inoltre ho anche prodotto una POTENTA ELETTRICA
PEL=e3·Q600 =0,618·26178 = 16178 W
che posso riutilizzare ad altri scopi .
Questo è sicuramente un buon sistema perché riutilizzo tutta la ANERGIA che di solito viene smaltita come elemento di rifiuto