METODO PER LA RISOLUZIONE DI PROBLEMI RIGUARDANTI I VAPORI SATURI
Dallo studio delle sostanze chimicamente pure, cioè sostanze formate solo da molecole della stessa natura, è stato possibile evidenziare che queste possono trovarsi, a seconda delle condizioni a cui sono sottoposte, nei tre stati fisici:
- FASE
SOLIDA: caratterizzata dell’avere forma e volume bloccati
- FASE
LIQUIDA: caratterizzata dall’avere forma libera e volume bloccato
- FASE
GASSOSA o AERIFORME: caratterizzata dall’avere forma e volume liberi
A seconda
delle caratteristiche assunte dalla fase aeriforme, dovute ai valori di
pressione, volume e temperatura assunti, questa si suddivide in due
sottocategorie:
- GAS che
possono essere PERFETTI o REALI
- VAPORI che
possono essere SATURI o SURRISCALDATI
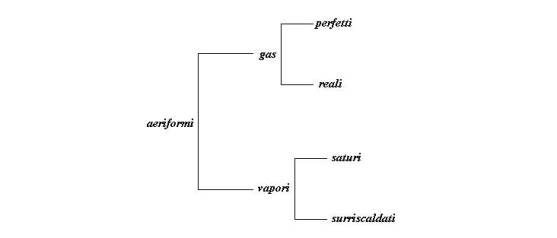
Fig. 1
Riferendo quanto detto ad un
diagramma termodinamico ![]() è possibile
evidenziare le zone in cui la sostanza assume le varie forme.
è possibile
evidenziare le zone in cui la sostanza assume le varie forme.
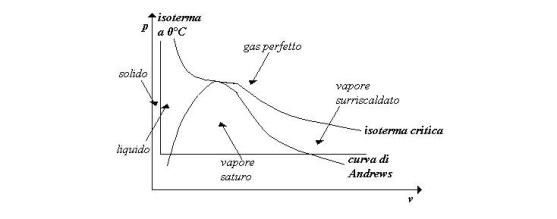
Fig. 2 – Diagramma termodinamico di una sostanza
chimicamente omogenea
Dallo
studio delle proprietà delle varie zone del diagramma è possibile vedere che i
gas perfetti sono regolati dall’equazione di stato:
![]() (1)
(1)
dove:
![]()
![]() (2)
(2)
![]() costante universale
costante universale ![]()
![]() massa molare della sostanza
considerata
massa molare della sostanza
considerata ![]()
![]() pressione
pressione ![]()
![]() volume specifico
volume specifico ![]()
![]() temperatura
temperatura ![]()
Allora i problemi relativi a
questa fase possono essere risolti con il metodo matematico canonico che fa uso
di un’equazione per ricavare un’incognita.
Per i vapori saturi invece
non abbiamo una legge fisica che lega le grandezze di pressione, volume e
temperatura come la precedente e quindi, per risolvere i problemi riferiti a
questi, non è possibile utilizzare la tecnica canonica descritta
precedentemente.
In questa situazione si fa
invece uso di dati raccolti in tabelle, ottenute sperimentalmente, e del valore
della grandezza![]() detta titolo, così
definita:
detta titolo, così
definita:
![]() (3)
(3)
Dalla definizione deduciamo
che il titolo è un numero puro compreso tra zero e uno, in particolare, se![]() la sostanza è completamente liquida senza presenza di
vapore, se
la sostanza è completamente liquida senza presenza di
vapore, se![]() la sostanza è completamente aeriforme senza presenza di
liquido.
la sostanza è completamente aeriforme senza presenza di
liquido.
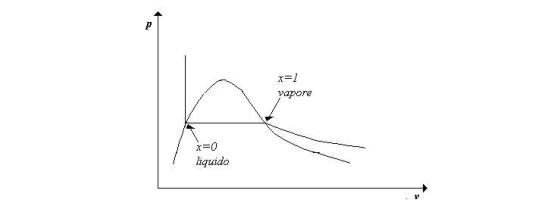
Fig. 3 – Diagramma termodinamico con indicazione del
titolo
Nelle tabelle vengono
infatti forniti i valori delle generiche proprietà: volume specifico ![]() , energia interna specifica
, energia interna specifica ![]() , entalpia specifica
, entalpia specifica ![]() ed entropia specifica
ed entropia specifica
![]() sia per il liquido
sia per il liquido![]() che per il vapore
che per il vapore![]() e quindi le proprietà del vapore saturo vengono ricavate
dalle interpolazioni lineari di queste, per cui avremo:
e quindi le proprietà del vapore saturo vengono ricavate
dalle interpolazioni lineari di queste, per cui avremo:
![]() (4)
(4)
![]() (5)
(5)
![]() (6)
(6)
![]() (7)
(7)
In alcune tabelle anziché trovare
i valori riferiti al vapore e al liquido, si possono trovare le proprietà
riferite al liquido e alla differenza
fra vapore e liquido indicate con il pedice ![]()
![]() dove:
dove:
![]() (8)
(8)
![]() (9)
(9)
![]() (10)
(10)
![]() (11)
(11)
In alcuni casi anziché ![]() possiamo trovare
possiamo trovare ![]() in quanto l’entalpia
specifica della differenza fra vapore e liquido viene anche detta calore latente di vaporizzazione.
in quanto l’entalpia
specifica della differenza fra vapore e liquido viene anche detta calore latente di vaporizzazione.
Da queste osservazioni è
possibile vedere che le proprietà dei vapori saturi sono linearmente dipendenti
dal titolo ![]() .
.
Per esempio la tabella delle
proprietà termodinamiche del vapore acqueo saturo riportata da: “1950 FOUNDAMENTAL HANDBOOK” tabula le seguenti grandezze:
|
|
|
Specific Volume |
Enthalpy
|
Entropy |
||||||
|
Temp |
Abs. press. |
Sat. solid |
Evap. |
Sat. vapor |
|
Evap. |
Sat. Vapor |
Sat. solid |
Evap. |
Vapor |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabella 1
che corrispondono, facendo riferimento alla
simbologia precedentemente usata, a:
|
|
|
|
|
|
|
|
|
|
|
|
Tabella 2
A scopo esemplificativo
riportiamo i valori compresi nell’intervallo di temperatura tra ![]() e
e ![]() del vapore acqueo
saturo.
del vapore acqueo
saturo.
|
|
|
Volume
specifico
|
Entalpia
|
Entropia |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
2.064 |
0.001001 |
65.01 |
65.01 |
75.53 |
2458 |
2533 |
0.267 |
8.443 |
8.710 |
|
19 |
2.197 |
0.001002 |
61.27 |
61.27 |
79.71 |
2455 |
2535 |
0.282 |
8.406 |
8.688 |
|
20 |
2.338 |
0.001002 |
57.77 |
57.77 |
83.90 |
2453 |
2537 |
0.296 |
8.369 |
8.665 |
|
21 |
2.487 |
0.001002 |
54.49 |
54.49 |
88.08 |
2451 |
2539 |
0.310 |
8.332 |
8.643 |
|
22 |
2.644 |
0.001002 |
51.43 |
51.43 |
92.27 |
2448 |
2541 |
0.324 |
8.296 |
8.621 |
|
23 |
2.810 |
0.001003 |
48.56 |
48.56 |
96.45 |
2446 |
2542 |
0.339 |
8.260 |
8.599 |
Tabella 3
Notiamo che questo tipo di
tabella è detto “a doppia entrata” in quanto le grandezze che vogliamo rilevare
possono essere ricavate sia se e’ nota la temperatura oppure se e’ nota la
pressione.
In alcune tabelle
riguardanti i vapori saturi, così come in quella da noi considerata, troviamo
solo alcuni valori di quelli descritti, cioè la pressione, la temperatura, il
volume, l’entalpia e l’entropia specifica; in questo caso per ricavare il
valore mancante, cioè l’energia interna differenziale specifica, si utilizza la
formula:
![]() (12)
(12)
Nel caso in cui manchi anche
il valore dell’entropia differenziale specifica, si utilizza la formula:
![]() (13)
(13)
Possiamo allora dire che il campo
dei vapori saturi è un’applicazione del calcolo empirico in cui la risoluzione
può avvenire nelle tre seguenti modalità:
- per
tentativi
- con
sistemi iterativi
- con metodi
matematici discreti
Si dice allora che queste
tecniche sono non canoniche perché i risultati ottenuti sono approssimati e
risultato di tecniche approssimate.
Vediamo allora un esercizio
la cui risoluzione utilizza la tecnica descritta.
ESERCIZIO: SCATOLONE ADIABATICO CONTENENTE VAPORI SATURI A TITOLO DIVERSO
Si consideri un recipiente
chiuso non deformabile, isolato dall’ambiente esterno e diviso in due parti
distinte tramite un setto isolante estraibile.
Si supponga che nelle due
porzioni del recipiente si trovi vapore acqueo saturo a diverso titolo, in
particolare nella zona indicata con A avremo
![]() di acqua alla
pressione di
di acqua alla
pressione di ![]() e con titolo pari a
0.1, mentre nella zona indicata con B
avremo
e con titolo pari a
0.1, mentre nella zona indicata con B
avremo ![]() di acqua alla
pressione di
di acqua alla
pressione di ![]() e con titolo pari a
0.5.
e con titolo pari a
0.5.
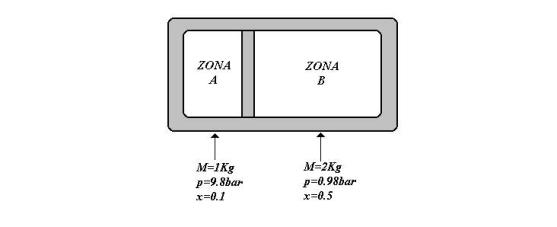
Fig. 4 – Scatolone adiabatico nello stato iniziale
Si
supponga di estrarre il setto che tiene divise le due sezioni e si calcoli la pressione, la temperatura e il
titolo dello stato di equilibrio che si è venuto a creare nel recipiente
considerato, dopo un tempo sufficientemente lungo che permette appunto il
raggiungimento di tale stato di equilibrio.
Fig. 5 – Scatolone adiabatico nello stato finale
Soluzione:
Innanzitutto, va notato che
lo stato di equilibrio finale raggiunto è ancora, così come per lo stato nella
zona A e nella zona B, uno stato di vapore acqueo saturo.
Eseguendo un’astrazione del
problema, dal mondo reale al mondo della fisica, s’interpreta il recipiente
come il sistema da studiare il quale è completamente descritto dalle coordinate
termodinamiche pressione ![]() e titolo
e titolo ![]() .
.
Consultiamo allora la
tabella delle proprietà termodinamiche del vapore acqueo saturo per ricavare i
valori della temperatura, dell’entalpia e del volume nella zona A e nella zona B.
|
|
|
Volume
specifico
|
Entalpia
|
Entropia |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
96 |
87.7 |
0.00104 |
1.912 |
1.913 |
402.2 |
2266 |
2669 |
1.261 |
6.140 |
7.402 |
|
97 |
91.0 |
0.00104 |
1.848 |
1.849 |
406.5 |
2264 |
2670 |
1.273 |
6.116 |
7.389 |
|
98 |
94.3 |
0.00104 |
1.786 |
1.787 |
410.7 |
2261 |
2672 |
1.284 |
6.093 |
7.377 |
|
99 |
97.8 |
0.00104 |
1.727 |
1.728 |
414.9 |
2258 |
2673 |
1.295 |
6.069 |
7.365 |
|
100 |
101.4 |
0.00104 |
1.670 |
1.671 |
419.1 |
2256 |
2675 |
1.307 |
6.046 |
7.353 |
|
101 |
105.0 |
0.00104 |
1.616 |
1.617 |
423.3 |
2253 |
2677 |
1.318 |
6.023 |
7.341 |
|
102 |
108.8 |
0.00104 |
1.563 |
1.564 |
427.6 |
2250 |
2678 |
1.329 |
6.000 |
7.329 |
|
103 |
112.7 |
0.00104 |
1.512 |
1.513 |
431.8 |
2248 |
2680 |
1.341 |
5.977 |
7.317 |
|
|
||||||||||
|
119 |
192.4 |
0.00105 |
0.917 |
0.918 |
499.5 |
2204 |
2704 |
1.517 |
5.622 |
7.139 |
|
120 |
193.6 |
0.00106 |
0.890 |
0.891 |
503.8 |
2202 |
2705 |
1.527 |
5.600 |
7.128 |
|
122 |
211.6 |
0.00106 |
0.839 |
0.840 |
512.3 |
2196 |
2708 |
1.549 |
5.558 |
7.107 |
|
124 |
225.1 |
0.00106 |
0.791 |
0.792 |
520.8 |
2190 |
2711 |
1.570 |
5.516 |
7.086 |
|
126 |
239.4 |
0.00106 |
0.747 |
0.748 |
529.3 |
2185 |
2714 |
1.592 |
5.474 |
7.066 |
|
128 |
254.5 |
0.00106 |
0.705 |
0.706 |
537.8 |
2179 |
2717 |
1.613 |
5.432 |
7.046 |
|
130 |
270.3 |
0.00107 |
0.667 |
0.668 |
546.3 |
2173 |
2720 |
1.634 |
5.391 |
7.026 |
|
132 |
286.8 |
0.00107 |
0.630 |
0.631 |
554.9 |
2167 |
2722 |
1.655 |
5.350 |
7.006 |
|
134 |
304.2 |
0.00107 |
0.596 |
0.597 |
563.4 |
2162 |
2725 |
1.676 |
5.309 |
6.986 |
|
136 |
322.4 |
0.00107 |
0.565 |
0.566 |
572.0 |
2156 |
2728 |
1.697 |
5.269 |
6.967 |
|
138 |
341.5 |
0.00107 |
0.535 |
0.536 |
580.6 |
2150 |
2730 |
1.718 |
5.229 |
6.948 |
|
140 |
361.5 |
0.00108 |
0.507 |
0.508 |
589.1 |
2144 |
2733 |
1.739 |
5.189 |
6.929 |
|
142 |
382.5 |
0.00108 |
0.481 |
0.482 |
597.7 |
2138 |
2736 |
1.759 |
5.150 |
6.910 |
|
144 |
404.3 |
0.00108 |
0.456 |
0.457 |
606.3 |
2132 |
2738 |
1.780 |
5.111 |
6.891 |
|
|
||||||||||
|
174 |
871.8 |
0.00111 |
0.221 |
0.221 |
736.6 |
2035 |
2772 |
2.081 |
4.552 |
6.633 |
|
176 |
913.9 |
0.00112 |
0.211 |
0.211 |
745.4 |
2028 |
2774 |
2.100 |
4.516 |
6.617 |
|
178 |
957.5 |
0.00112 |
0.202 |
0.202 |
754.2 |
2021 |
2776 |
2.120 |
4.481 |
6.601 |
|
180 |
1002 |
0.00112 |
0.193 |
0.193 |
763.1 |
2014 |
2777 |
2.139 |
4.446 |
6.585 |
|
182 |
1049 |
0.00113 |
0.185 |
0.185 |
771.9 |
2007 |
2779 |
2.158 |
4.410 |
6.569 |
|
184 |
1098 |
0.00113 |
0.177 |
0.177 |
780.8 |
2000 |
2781 |
2.178 |
4.375 |
6.554 |
Tabella 4
Ricordando che:
![]()
![]()
Dalla tabella si ricava che
la temperatura nella zona A è pari a ![]() mentre la temperatura
nella zona B e’ pari a
mentre la temperatura
nella zona B e’ pari a ![]() .
.
Graficamente rappresentando questi
dati sul diagramma termodinamico ![]() si ottiene:
si ottiene:
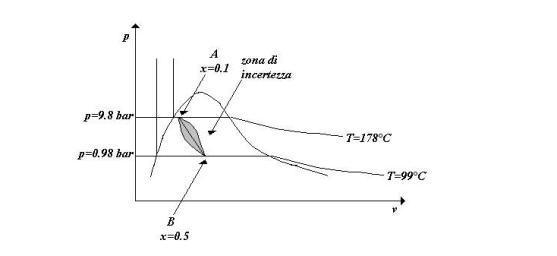
Fig. 6 – Diagramma termodinamico dell’acqua
Come specificato dal testo,
studiamo lo stato della zona C
quando questa raggiunge l’equilibrio, in quanto non sarebbe possibile
descrivere con le coordinate termodinamiche l’evoluzione di un sistema.
Supponiamo allora che il
comportamento del sistema nei due punti A
e B sia legato da una relazione
lineare, come conseguenza avremo che il punto C, di coordinate termodinamiche ![]() dovrà trovarsi nel
diagramma termodinamico
dovrà trovarsi nel
diagramma termodinamico ![]() sulla retta passante
per i due punti A e B.
sulla retta passante
per i due punti A e B.
Supponendo che le grandezze
termodinamiche siano determinabili come media pesata delle grandezze nei punti A e B ed essendo un sistema chiuso, per cui vale la conservazione della
massa
![]() (14)
(14)
possiamo dire che:
![]() (15)
(15)
Ammettendo un certo margine di
errore, dovuto alla reale non linearità della trasformazione effettuata, si può
pensare che le coordinate termodinamiche del punto C ![]() siano individuate
dalla zona segnata sul diagramma (Fig.6).
siano individuate
dalla zona segnata sul diagramma (Fig.6).
Risolviamo ora numericamente
il problema: siccome il sistema considerato è un sistema chiuso e
indeformabile, per la risoluzione del problema si fa uso della conservazione
della massa, già vista precedentemente, della conservazione del volume e del
primo Principio della termodinamica o
Principio della conservazione dell’energia.
Dalla
conservazione della massa come già anticipato dalla relazione (14), otteniamo:
![]()
dalla conservazione del volume si ricava che:
![]() (16)
(16)
occorre allora trovare i volumi ![]() e
e ![]() ; a tal fine si utilizzano le relazioni:
; a tal fine si utilizzano le relazioni:
![]() (17)
(17)
![]() (18)
(18)
Note le masse ![]() e
e ![]() rimangono da determinare
i volumi specifici
rimangono da determinare
i volumi specifici ![]() e
e ![]() ; per fare ciò si utilizzano le relazioni:
; per fare ciò si utilizzano le relazioni:
![]() (19)
(19)
![]() (20)
(20)
dalla tabella precedente si ricava che:
![]()
![]()
![]()
![]()
sostituendo questi valori nelle relazioni (19) e
(20), si ottiene:
![]()
![]()
Sostituendo
i valori dei volumi specifici, appena ricavati, nelle relazioni (17) e (18), si
ricava:
![]()
![]()
sostituendo i valori di ![]() e
e ![]() nella relazione (16)
si ottiene:
nella relazione (16)
si ottiene:
![]()
dividendo questo valore per la massa ![]() otteniamo il volume
specifico
otteniamo il volume
specifico ![]()
![]() (21)
(21)
Come già
detto, nello stato di equilibrio che stiamo studiando abbiamo ancora del vapore
acqueo saturo, per cui vale ancora una relazione del tipo:
![]() (22)
(22)
Poiché, il sistema e’ per
ipotesi termicamente e meccanicamente isolato, si ha che:
![]()
![]()
e quindi il primo Principio della termodinamica, o
Principio della conservazione dell’energia, assume la forma:
![]() (23)
(23)
da cui:
![]() (24)
(24)
Occorre allora ricavare i valori
dell’energia interna nella sezione A
e nella sezione B; a tal proposito
si utilizzano le relazioni:
![]() (25)
(25)
![]() (26)
(26)
Note le masse ![]() e
e ![]() rimangono da
determinare i valori dell’energia specifica
rimangono da
determinare i valori dell’energia specifica ![]() e
e ![]() ; per fare ciò si utilizzano le relazioni:
; per fare ciò si utilizzano le relazioni:
![]() (27)
(27)
![]() (28)
(28)
In questo caso il valore
dell’energia interna specifica viene sostituito dal valore dell’entalpia
specifica del liquido, riportata nella tabella delle proprietà termodinamiche,
in quanto molto simili, per cui:
![]()
![]()
I valori dell’energia interna
specifica differenziale vengono invece ricavati tramite le formule:
![]() (29)
(29)
![]() (30)
(30)
dove:
![]()
![]()
![]()
![]()
![]()
![]()
sostituendo questi valori nelle relazioni (29) e
(30) si ottiene:
![]()
![]()
sostituendo i valori ricavati nelle relazioni (27) e
(28) si ottiene:
![]()
![]()
sostituendo nelle relazioni (25) e (26) si ottiene:
![]()
![]()
Dalla
relazione (24) si ricava allora che:
![]()
allora il valore specifico dell’energia interna nello
stato di equilibrio C è:
![]() (31)
(31)
Pertanto ricordando, come
già detto, che nello stato di equilibrio C
abbiamo ancora vapore acqueo saturo, possiamo riscrivere la relazione
precedente nel seguente modo:
![]() (32)
(32)
Considerando le equazioni
(22) e (32) otteniamo un sistema di equazioni in sette incognite e quindi
matematicamente mal posto.
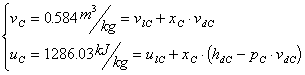
Questo sistema però, anche
se matematicamente mal posto, è fisicamente ben posto in quanto sei delle sette
incognite, cioè tutte tranne il titolo ![]() , sono poste sulla stessa riga della tabella delle proprietà
termodinamiche e quindi sono discretizzate, cioè variano tutte insieme.
, sono poste sulla stessa riga della tabella delle proprietà
termodinamiche e quindi sono discretizzate, cioè variano tutte insieme.
A questo punto, per
risolvere il problema, l’unica via possibile è quella “per tentativi”, cioè si
sceglie una pressione, ovviamente ricordando di farla rientrare nella zona
della soluzione grafica approssimativa, vista precedentemente, si ricavano i
valori incogniti dalla tabella e si inseriscono nelle relazioni del sistema. Se
il risultato si avvicina al risultato che abbiamo calcolato abbiamo risolto il
problema, in caso di discordanza significativa occorre invece cambiare
pressione, e quindi riga della tabella, ed eseguire lo stesso procedimento.
Si supponga di scegliere una
pressione
![]()
allora dalla
tabella ricaviamo i valori:
![]()
![]()
![]()
![]()
sostituendoli nella relazione (22) si ottiene:
![]()
che sostituita nella relazione (32) dà:
![]()
Siccome i
due valori sono sensibilmente diversi si sceglie una nuova pressione, e quindi
una nuova riga, e si ripetono i conti:
![]()
da cui otteniamo:
![]()
![]()
![]()
![]()
per cui otteniamo:
![]()
che sostituito dà:
![]()
Siccome i
dati sono ancora discordanti scegliamo una nuova pressione:
![]()
da cui:
![]()
![]()
![]()
![]()
per cui otteniamo:
![]()
che sostituito dà:
![]()
Siccome questo dato è
soddisfacente, possiamo concludere che la pressione dello stato di equilibrio
nella zona C è:
![]()
la temperatura è:
![]()
il titolo del vapore saturo è:
![]()
I SISTEMI APERTI
Finora ci siamo limitati a
considerare i cosiddetti sistemi chiusi cioè una regione di spazio delimitata
da un confine, che può essere reale o apparente, rigida o deformabile, che
impedisce lo scambio di materia fra il sistema e l’ambiente. Ciò vuol dire che
la massa si mantiene costante nel tempo e, per di più, le molecole che la
costituiscono sono sempre le stesse.
In realtà, come già sappiamo
dallo studio del primo Principio della termodinamica, la Teoria della
relatività di Einstein lega la variazione di massa alla variazione di energia
![]() (33)
(33)
dove:
![]()
è la velocità della luce.
Nello studio da noi condotto
trascuriamo quanto sostenuto dalla Teoria della relatività di Einstein in
quanto, avendo un elevato coefficiente di proporzionalità, ad una sensibile
variazione di energia corrisponde un’irrilevante variazione di massa.
Estendiamo ora lo studio
finora condotto ai cosiddetti sistemi aperti ricavando per questi il bilancio
della massa e il bilancio dell’energia.
Innanzitutto diamo la
definizione rigorosa di sistema aperto: si definisce sistema aperto un determinato volume dello spazio racchiuso da una
superficie, detta confine del
sistema, attraverso la quale può entrare o uscire una certa quantità di materia.
Il confine e il volume, in esso racchiuso, sono entrambi invarianti nel tempo.
Tutti i fenomeni che
avvengono nel volume, e quindi anche i flussi di materia, sono considerati
trasformazioni del sistema.
La maggior parte della
superficie di confine di questo sistema è impermeabile al flusso di materia,
presenta però alcune zone, dette sezioni d’ingresso, attraverso le quali la
materia può entrare e alcune zone, dette sezioni d’uscita, attraverso le quali
la materia può uscire, queste vengono quindi realizzate attraverso una
superficie permeabile.
Nel nostro studio
considereremo dei sistemi aperti semplici che presentano una sola sezione
d’ingresso e una sola sezione d’uscita a massa costante, cioè la stessa
quantità di massa che entra deve anche uscire. Ciò che consideriamo è allora un
sistema aperto stazionario in cui anche la temperatura, la pressione, il volume
e i flussi del sistema devono essere gli stessi in ogni istante di tempo.
La stazionarietà del
sistema non è una caratteristica di
tutti i sistemi aperti, può però essere realizzata, in casi particolari
attraverso opportuni sistemi di controllo. Un esempio di sistema aperto
stazionario è un impianto termoelettrico.
Un sistema aperto con una sola
sezione d’ingresso e una sola sezione d’uscita può essere schematizzato nel
seguente modo:
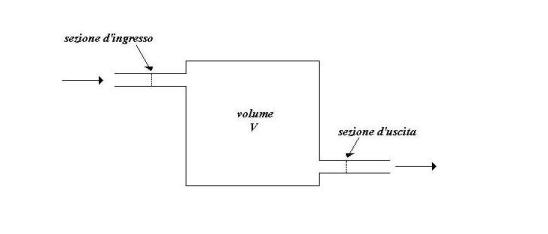
Fig. 7 – Sistema aperto con una sola sezione
d’ingresso e una sola sezione d’uscita
Dove abbiamo una superficie
che racchiude il volume ![]() e una sola sezione d’ingresso
e una sola sezione d’ingresso ![]() e una sola sezione
d’uscita
e una sola sezione
d’uscita ![]() .
.
Per affrontare lo studio di
questo sistema aperto semplice si
utilizzano i metodi d’indagine termodinamica visti per i sistemi chiusi: si
consideri un sistema chiuso, detto sistema ausiliario, che si sposta nello
spazio per un certo intervallo di tempo e contemporaneamente una regione di
spazio fissa che viene attraversata, nell’intervallo di tempo, dal sistema:
questa regione di spazio costituisce il sistema aperto.
Per rappresentare
graficamente quanto detto si rappresenta il sistema in una forma semplificata
rispetto a quanto visto precedentemente, in particolare rappresentiamo il
sistema aperto come un tubo con una superficie laterale impermeabile.
Allora all’istante ![]() avremo:
avremo:
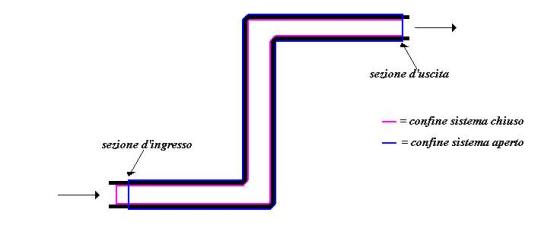
Fig. 8 – Sistema aperto
all’istante iniziale
dopo un tempo ![]() avremo:
avremo:
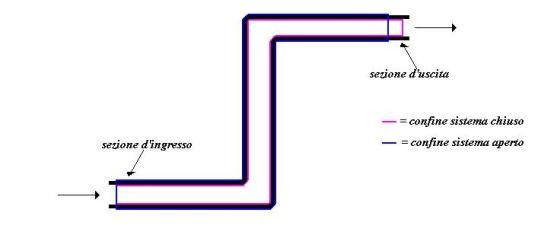
Fig. 9 – Sistema aperto
all’istante finale
Al trascorrere del tempo, al
sistema aperto è associato sia una variazione di massa che una variazione di
energia. Come già anticipato, supponiamo che la massa rimanga costante, cioè
che la quantità di massa che entra dalla sezione d’ingresso sia uguale alla
massa che esce dalla sezione d’uscita.
Va notato che i risultati
ricavati da questo sistema semplice saranno poi estensibili al caso di sistemi
aperti più complessi con più sezioni
d’ingresso e più sezioni d’uscita.
Vediamo allora il bilancio
dell’energia.
BILANCIO DI
ENERGIA PER UN SISTEMA APERTO STAZIONARIO
Supponiamo che il nostro
sistema ad un certo istante ![]() abbia una certa massa
abbia una certa massa
![]() all’interno del
sistema e una certa massa
all’interno del
sistema e una certa massa ![]() nel tubo collegato
alla sezione
nel tubo collegato
alla sezione ![]() pronta ad entrare; a
queste masse, sono associate le relative energie
pronta ad entrare; a
queste masse, sono associate le relative energie ![]() e
e ![]() .
.
Dopo un tempo ![]() , e quindi all’istante
, e quindi all’istante ![]() , la massa
, la massa ![]() è entrata nel sistema
e si ha una massa
è entrata nel sistema
e si ha una massa ![]() , nel tubo collegato alla sezione d’uscita
, nel tubo collegato alla sezione d’uscita ![]() , che esce dal sistema.
, che esce dal sistema.
Come precedentemente
anticipato supponiamo che il sistema sia stazionario e quindi che la quantità
di massa ![]() che entra nel sistema
sia uguale alla quantità di massa
che entra nel sistema
sia uguale alla quantità di massa ![]() che esce, allora
all’istante
che esce, allora
all’istante ![]() avremo ancora una
massa
avremo ancora una
massa ![]() uguale a quella
presente all’istante
uguale a quella
presente all’istante ![]() .
.
Come nello stato precedente,
alle masse ![]() e
e ![]() sono associate le
relative energie
sono associate le
relative energie ![]() e
e ![]() .
.
Notiamo che mentre la massa ![]() è uguale alla massa
è uguale alla massa ![]() , per l’ipotesi di stazionarietà fatta, l’energia
, per l’ipotesi di stazionarietà fatta, l’energia ![]() è diversa
dall’energia
è diversa
dall’energia ![]() .
.
Vediamo
allora il bilancio di energia di questo sistema, utilizzando il concetto di
sistema ausiliario, cioè il sistema chiuso che si sposta nel tempo; in questo
modo sarà possibile utilizzare i concetti studiati per i sistemi chiusi per
ricavare le nozioni che descrivono i sistemi aperti.
Vediamo allora come la
situazione descritta precedentemente per il sistema aperto possa essere
interpretata con il sistema chiuso ausiliario: supponiamo che all’istante ![]() , al quale si incomincia ad osservare il sistema, il sistema
chiuso ausiliario sia in posizione tale da comprendere tutta la massa contenuta
nel sistema aperto di volume
, al quale si incomincia ad osservare il sistema, il sistema
chiuso ausiliario sia in posizione tale da comprendere tutta la massa contenuta
nel sistema aperto di volume ![]() più la porzione di
massa
più la porzione di
massa ![]() nel tubo collegato
alla sezione d’ingresso
nel tubo collegato
alla sezione d’ingresso ![]() . Supponiamo poi, che all’istante
. Supponiamo poi, che all’istante ![]() , al quale concludo l’osservazione del sistema, il sistema
chiuso ausiliario sia in posizione tale da comprendere tutta la massa contenuta
nel sistema aperto di volume
, al quale concludo l’osservazione del sistema, il sistema
chiuso ausiliario sia in posizione tale da comprendere tutta la massa contenuta
nel sistema aperto di volume ![]() più la porzione di
massa
più la porzione di
massa ![]() contenuta nel tubo
collegato alla sezione d’uscita
contenuta nel tubo
collegato alla sezione d’uscita ![]() .
.
Notiamo subito che per
esprimere il principio di conservazione dell’energia per un sistema aperto
dovremo considerare anche forme di energia quali l’energia cinetica e l’energia
potenziale, supposte trascurabili nel caso di sistemi chiusi, in quanto
considerati sistemi privi di un moto d’insieme.
Allora le energie ![]() e
e ![]() associate alle masse
associate alle masse ![]() e
e ![]() sono date dalle
formule:
sono date dalle
formule:
![]() (34)
(34)
![]() (35)
(35)
dove le varie forme di energia sono state espresse
tramite i valori specifici, per cui:
![]() = ENERGIA CINETICA SPECIFICA DELLA MASSA
= ENERGIA CINETICA SPECIFICA DELLA MASSA ![]() (36)
(36)
![]() = ENERGIA CINETICA SPECIFICA DELLA MASSA
= ENERGIA CINETICA SPECIFICA DELLA MASSA ![]() (37)
(37)
![]() = ENERGIA POTENZIALE SPECIFICA DELLA MASSA
= ENERGIA POTENZIALE SPECIFICA DELLA MASSA ![]() (38)
(38)
![]() = ENERGIA POTENZIALE SPECIFICA
DELLA MASSA
= ENERGIA POTENZIALE SPECIFICA
DELLA MASSA ![]() (39)
(39)
![]() = ENERGIA INTERNA SPECIFICA
DELLA MASSA
= ENERGIA INTERNA SPECIFICA
DELLA MASSA ![]() (40)
(40)
![]() = ENERGIA INTERNA SPECIFICA
DELLA MASSA
= ENERGIA INTERNA SPECIFICA
DELLA MASSA ![]() (41)
(41)
Il bilancio dell’energia del
sistema aperto può allora essere fatto appoggiandosi al sistema ausiliario
chiuso per cui vale il primo Principio della termodinamica o Principio di
conservazione dell’energia:
![]() (42)
(42)
nel quale, come già sappiamo, la variazione di
energia può avvenire solo per scambi di
lavoro e di calore.
Per come abbiamo definito
prima il sistema chiuso, all’istante ![]() l’energia è data
dalla somma dell’energia associata alla massa del sistema aperto
l’energia è data
dalla somma dell’energia associata alla massa del sistema aperto ![]() e dell’energia
associata alla massa entrante nel sistema
e dell’energia
associata alla massa entrante nel sistema ![]() , mentre all’istante
, mentre all’istante ![]() l’energia è data
dalla somma dell’energia associata alla massa del sistema aperto
l’energia è data
dalla somma dell’energia associata alla massa del sistema aperto ![]() e dell’energia
associata alla massa uscente dal sistema
e dell’energia
associata alla massa uscente dal sistema ![]() .
.
![]() (43)
(43)
![]() (44)
(44)
Allora il bilancio di
energia visto precedentemente può essere riscritto nel seguente modo:
![]() (45)
(45)
Semplificando l’energia
associata alla massa del sistema aperto, perché per ipotesi il sistema è stazionario e quindi la massa non
cambia, otteniamo:
![]() (46)
(46)
dove ![]() , che indicheremo con
, che indicheremo con ![]() , è il calore scambiato tra il sistema e l’ambiente
attraverso il confine, mentre
, è il calore scambiato tra il sistema e l’ambiente
attraverso il confine, mentre ![]() è il lavoro, il quale
è formato da tre contributi: il lavoro scambiato attraverso l’albero rotante
che indicheremo con
è il lavoro, il quale
è formato da tre contributi: il lavoro scambiato attraverso l’albero rotante
che indicheremo con ![]() , il lavoro compiuto dal fluido per introdurre nel sistema la
massa
, il lavoro compiuto dal fluido per introdurre nel sistema la
massa ![]() , che indichiamo con
, che indichiamo con ![]() , e il lavoro compiuto dal fluido per estrarre dal sistema la
massa
, e il lavoro compiuto dal fluido per estrarre dal sistema la
massa ![]() , che indichiamo con
, che indichiamo con ![]() .
.
Il lavoro necessario per
spingere la massa ![]() all’interno del
sistema vale:
all’interno del
sistema vale:
![]() (47)
(47)
dove ![]() è lo spostamento
compiuto nel tempo
è lo spostamento
compiuto nel tempo ![]() e
e ![]() è la forza necessaria
per contrastare la pressione, che indichiamo con
è la forza necessaria
per contrastare la pressione, che indichiamo con ![]() , esercitata dalla massa
, esercitata dalla massa ![]() del fluido entrante.
del fluido entrante.
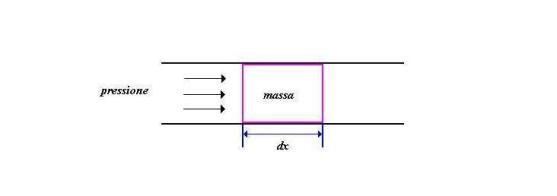
Fig. 10
Supponendo
che la sezione si mantenga costante e così pure la pressione, possiamo scrivere:
![]() (48)
(48)
e quindi:
![]() (49)
(49)
ma:
![]() (50)
(50)
e quindi la relazione precedente diventa:
![]() (51)
(51)
ricordando che:
![]() (52)
(52)
otteniamo:
![]() (53)
(53)
Analogamente il lavoro
necessario per estrarre dal sistema la massa ![]() vale:
vale:
![]() (54)
(54)
Il lavoro ![]() , essendo un lavoro d’introduzione di materia, è un lavoro
ricevuto dal sistema e quindi, per convenzione, avrà segno negativo nel
bilancio di energia, mentre il lavoro
, essendo un lavoro d’introduzione di materia, è un lavoro
ricevuto dal sistema e quindi, per convenzione, avrà segno negativo nel
bilancio di energia, mentre il lavoro ![]() , essendo un lavoro di estrazione di materia, è un lavoro
emesso dal sistema e quindi, per convenzione, avrà segno positivo nel bilancio
di energia.
, essendo un lavoro di estrazione di materia, è un lavoro
emesso dal sistema e quindi, per convenzione, avrà segno positivo nel bilancio
di energia.
Allora sostituendo le
relazioni dei lavori ![]() e
e ![]() , appena ricavate, con le convenzioni di segno esposte
precedentemente, nel bilancio di energia, otteniamo:
, appena ricavate, con le convenzioni di segno esposte
precedentemente, nel bilancio di energia, otteniamo:
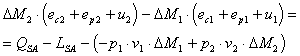 (55)
(55)
riscriviamo allora la relazione nel seguente modo:
![]() (56)
(56)
dividendo ambo i membri per la massa, in quanto ![]() per ipotesi,
otteniamo:
per ipotesi,
otteniamo:
![]() (57)
(57)
ricordando la definizione di entalpia, espressa
tramite le grandezze specifiche
![]() (58)
(58)
la relazione del bilancio di energia in forma
specifica può essere riscritta nel seguente modo:
![]() (59)
(59)
Se ora riconsideriamo
l’equazione del bilancio di energia (56) e dividiamo ambo i membri per
l’intervallo di tempo ![]() otteniamo, ricordando sempre che abbiamo considerato
otteniamo, ricordando sempre che abbiamo considerato ![]() , che:
, che:
![]() (60)
(60)
dove:
![]() (61)
(61)
![]() (62)
(62)
![]() (63)
(63)
La relazione (60) ricavata è
equivalente alla relazione (59) precedentemente ricavata, in questo caso però
il bilancio di energia del sistema viene espresso tramite la portata.
Per completare il bilancio
dell’energia del nostro sistema aperto dobbiamo sostituire le relazioni
dell’energia cinetica e dell’energia potenziale, cosi definite:
![]() (64)
(64)
![]() (65)
(65)
per cui le relative grandezze specifiche sono:
![]() (66)
(66)
![]() (67)
(67)
dove ![]() è la massa,
è la massa, ![]() la velocità,
la velocità, ![]() l’accelerazione di
gravità che vale
l’accelerazione di
gravità che vale ![]() e
e ![]() l’altezza.
l’altezza.
Sostituendo queste relazioni
nel bilancio dell’energia (59) si ottiene:
![]() (68)
(68)
che può essere riscritta come:
![]() (69)
(69)
Nel caso in cui le variazioni
di energia cinetica e di energia potenziale siano trascurabili si ottiene la
relazione:
![]() (70)
(70)
Il risultato ottenuto è però
affetto da un errore che consiste nell’avere considerato l’energia cinetica di
un fluido costante quando in realtà non lo è.
CALCOLO DELL’ ENERGIA CINETICA DI
UN FLUIDO
La velocità, e quindi
l’energia cinetica, di un fluido che scorre in un condotto non è costante in
ogni punto ma varia in funzione della sezione che si sta considerando e in funzione
della distanza dall’asse del condotto. Ciò si spiega con il fatto che al
variare della sezione e al variare della distanza dall’asse del condotto varia
il moto del fluido.
I tipi di moto di un fluido all’interno
di un condotto sono infiniti e variano tra le condizioni estreme di moto laminare e moto turbolento.
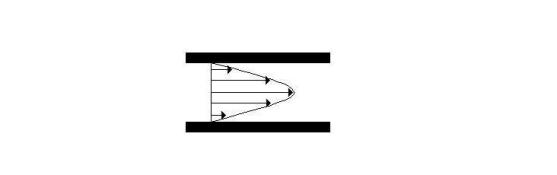
Fig. 11 – Moto laminare
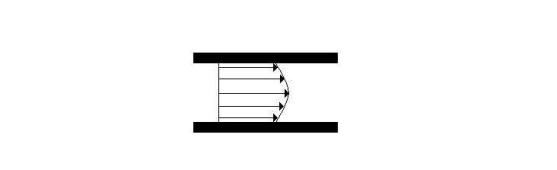
Fig. 12 – Moto turbolento
Per lo studio di questi due
moti si consideri il fluido suddiviso in tanti “filetti”: nel caso di moto
laminare questi filetti si muovono senza mai intersecarsi, nel caso di moto
turbolento, invece, i filetti si mescolano dando luogo a vortici e quindi la
velocità varia continuamente e irregolarmente nel tempo.
Come abbiamo già detto, la
velocità varia in funzione della sezione, in particolare per il moto laminare
varia con legge parabolica del secondo ordine e, per condotti a sezione
costante, è sempre diretta parallelamente all'asse del condotto; per il moto
turbolento, invece, la velocità è ancora maggiore vicino all’asse e diminuisce
andando verso le pareti del condotto, ma il suo profilo, rispetto a quello del
moto laminare, è più appiattito.
Per ricavare l’energia
cinetica, allora, si fa uso di un opportuno valore medio della velocità, definito
come quel valore ipotetico della componente della velocità parallela all’asse
che, uniforme su tutta la sezione ![]() , sarebbe in grado di dare la stessa portata in volume che si
ha nella realtà.
, sarebbe in grado di dare la stessa portata in volume che si
ha nella realtà.
![]() (71)
(71)
dove:
![]() velocità
velocità
![]() vettore con valore locale della
velocità
vettore con valore locale della
velocità
![]() vettore normale alla sezione
vettore normale alla sezione
Andando a considerare solo
le componenti normali del vettore ![]() si considerano solo le componenti che fanno entrare o
uscire il fluido. Allora la massa, che nell’unità di tempo, attraversa la
generica sezione
si considerano solo le componenti che fanno entrare o
uscire il fluido. Allora la massa, che nell’unità di tempo, attraversa la
generica sezione ![]() del conduttore, cioè
la portata, è data dalla relazione:
del conduttore, cioè
la portata, è data dalla relazione:
![]() (72)
(72)
dove ![]() è la densità del
fluido sulla sezione.
è la densità del
fluido sulla sezione.
Considerando la densità di
massa costante su tutta la sezione, la relazione precedente può essere
riscritta come:
![]() (73)
(73)
allora la portata in volume è:
![]() (74)
(74)
Dalla relazione (73) è allora possibile ricavare l’espressione della velocità media
![]() (75)
(75)
e con questa ricavare l’energia cinetica che il
sistema possiede nell’unità di tempo:
![]() (76)
(76)
Dividendo questa per la
massa otteniamo la relazione espressa tramite le grandezze specifiche:
![]() (77)
(77)
In realtà l’energia cinetica
posseduta dal fluido è maggiore di quella che abbiamo appena ricavato in quanto
il profilo di velocità non è uniforme in modulo.
Si introduce perciò un
coefficiente correttivo ![]() ottenendo così:
ottenendo così:
![]() (78)
(78)
dove il fattore ![]() può assumere tutti i
valori compresi tra i valori uno e due, in particolare abbiamo
può assumere tutti i
valori compresi tra i valori uno e due, in particolare abbiamo ![]() nel caso di moto
completamente laminare per il quale, come già detto, la velocità varia nella
sezione con legge parabolica di secondo ordine e il profilo assunto prende il
nome di profilo parabolico o di Poiseuille, tipico delle sostanze
oleose, e abbiamo
nel caso di moto
completamente laminare per il quale, come già detto, la velocità varia nella
sezione con legge parabolica di secondo ordine e il profilo assunto prende il
nome di profilo parabolico o di Poiseuille, tipico delle sostanze
oleose, e abbiamo ![]() nel caso di moto così
turbolento da poter considerare il profilo di velocità piatto.
nel caso di moto così
turbolento da poter considerare il profilo di velocità piatto.
Alla luce
di queste considerazioni la relazione (59) può essere riscritta in questo modo:
![]() (79)
(79)
da cui:
![]() (80)
(80)
BILANCIO DI MASSA DI UN SISTEMA
APERTO
Nello studio da noi condotto
abbiamo supposto che il sistema sia stazionario e quindi che la massa si mantenga
costante nel tempo, implicando che la quantità di massa che entra nel sistema
sia uguale alla massa che esce; va sottolineato che la quantità di massa si
mantiene costante ma non sarà più costituita dalle stesse molecole come
accadeva nei sistemi chiusi.
In generale però, come già
detto, in un sistema aperto abbiamo sia
una variazione d’energia che una variazione di massa, che implica una quantità
di massa entrante diversa da quella uscente.
In questo caso occorre
trovare il bilancio di massa in modo analogo a quanto fatto per quello
d’energia, in quanto le considerazioni riferite al sistema sono le stesse.
Indichiamo con ![]() la massa nel volume
del sistema all’istante iniziale e con
la massa nel volume
del sistema all’istante iniziale e con ![]() la massa nel volume
del sistema all’istante finale.
la massa nel volume
del sistema all’istante finale.
Così come per l’energia, per
calcolare il bilancio di massa, utilizziamo il sistema chiuso ausiliario che
all’istante ![]() avrà una massa pari
alla somma della massa contenuta nel volume del sistema
avrà una massa pari
alla somma della massa contenuta nel volume del sistema ![]() e della massa pronta ad entrare
e della massa pronta ad entrare ![]() , mentre all’istante
, mentre all’istante ![]() avrà una massa pari
alla somma della massa contenuta nel volume del sistema
avrà una massa pari
alla somma della massa contenuta nel volume del sistema ![]() e della massa uscente
e della massa uscente![]() .
.
Scriviamo allora il bilancio
della massa riferito al sistema ausiliario chiuso che in quanto tale ha
mantenuto costante la sua massa al trascorrere del tempo.
![]() (81)
(81)
Questa la possiamo
riscrivere come:
![]() (82)
(82)
dividendo ambo i membri per l’intervallo di tempo ![]() otteniamo:
otteniamo:
![]() (83)
(83)
Il primo membro della
relazione rappresenta il rapporto incrementale, quindi passando al limite per ![]() , per la definizione di derivata, si ottiene:
, per la definizione di derivata, si ottiene:
![]() (84)
(84)
dove:
![]() PORTATA DI MASSA RIFERITA A
PORTATA DI MASSA RIFERITA A ![]() (85)
(85)
![]() PORTATA DI MASSA RIFERITA A
PORTATA DI MASSA RIFERITA A ![]() (86)
(86)
Allora ![]() rappresenta la
variazione di massa del sistema aperto, mentre la portata di massa
rappresenta la
variazione di massa del sistema aperto, mentre la portata di massa ![]() e
e ![]() rappresentano
rispettivamente la massa che entra nella sezione
rappresentano
rispettivamente la massa che entra nella sezione ![]() e nella sezione
e nella sezione ![]() nell’unità di tempo.
nell’unità di tempo.
In
generale nel caso in cui il sistema abbia più sezioni d’ingresso e più sezioni
d’uscita scriveremo:
![]() (87)
(87)
dove le portate di massa delle sezioni d’ingresso si
sommano mentre quelle delle sezioni d’uscita si sottraggono.
Siccome all’interno di un
sistema non avvengono reazioni chimiche ogni specie chimica presente può essere
descritta con una relazione di questo tipo.
Vediamo ora alcuni esempi di
sistemi aperti.
ESERCIZIO: LA CALDAIA
Si supponga di avere una
caldaia come quella in figura, in grado di vaporizzare alla pressione di ![]() e alla temperatura di
e alla temperatura di
![]() , una massa pari a
, una massa pari a ![]() d’acqua alla
temperatura di
d’acqua alla
temperatura di ![]() . Si determini la quantità di calore assorbita durante tale
processo.
. Si determini la quantità di calore assorbita durante tale
processo. 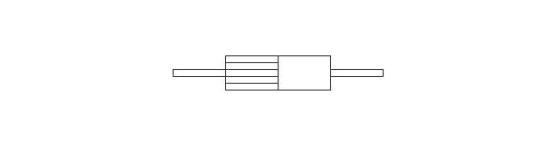
Fig. 13 – Schematizzazione di una caldaia
Soluzione:
La caldaia è un sistema
aperto capace di trasformare l’acqua che riceve in ingresso in vapore.
Siccome la caldaia non ha
alberi che ruotano e ricordando che:
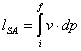 (88)
(88)
il lavoro è nullo; supponiamo inoltre che l’energia
cinetica e l’energia potenziale siano trascurabili, allora in questo sistema
abbiamo solamente scambio di calore e quindi per la relazione (70) ricavata
precedentemente, per un sistema aperto stazionario, avremo:
![]() (89)
(89)
Rappresentiamo graficamente la
situazione descritta dalle specifiche del problema mediante il diagramma
termodinamico .
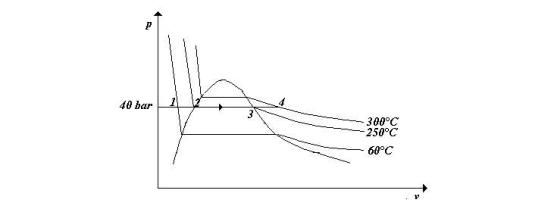
Fig. 14 – Diagramma
termodinamico dell’acqua
La trasformazione effettuata
dalla caldaia tra lo stato iniziale 1 caratterizzato da ![]() e
e ![]() e lo stato finale 4
caratterizzato da
e lo stato finale 4
caratterizzato da ![]() e
e ![]() è una trasformazione
e isobara.
è una trasformazione
e isobara.
Questa
trasformazione può essere suddivisa, identificando gli stati intermedi 2 e 3,
mantenendo sempre la pressione costante, in tre passi:
-
TRASFORMAZIONE DALLO STATO 1 ALLO STATO 2: fornendo calore la
massa
d’acqua pari a ![]() viene scaldata e
portata dalla temperatura
viene scaldata e
portata dalla temperatura ![]() alla
alla
temperatura ![]() , dove
, dove ![]() è la temperatura
d’ebollizione dell’acqua alla pressione di
è la temperatura
d’ebollizione dell’acqua alla pressione di
![]() , consultando la tabella delle proprietà dell’acqua ricaviamo
che
, consultando la tabella delle proprietà dell’acqua ricaviamo
che![]() .
.
- TRASFORMAZIONE DALLO STATO 2 ALLO STATO 3: questo è un processo
di
vaporizzazione a temperatura costante per cui ![]() in cui il calore
in cui il calore
fornito
serve per portare l’acqua dallo stato liquido allo stato di vapore secco.
-
RASFORMAZIONE DALLO STATO 3 ALLO STATO 4: fornendo ulteriore
calore il
vapore viene portato dalla temperatura ![]() alla temperatura
alla temperatura
![]() trasformando così il
vapore saturo in vapore surriscaldato.
trasformando così il
vapore saturo in vapore surriscaldato.
Allora la
relazione (89) scritta precedentemente, può essere riscritta nel seguente modo:
![]() (90)
(90)
Calcoliamo allora la
differenza d’entalpia nelle varie trasformazioni:
![]() questa è la variazione
d’entalpia di un liquido che viene scaldato, allora dalla teoria dei liquidi
sappiamo che vale:
questa è la variazione
d’entalpia di un liquido che viene scaldato, allora dalla teoria dei liquidi
sappiamo che vale:
![]() (91)
(91)
dove:
![]()
in quanto per i liquidi il calore specifico a
pressione costante è uguale al calore specifico a volume costante; questo
valore che viene ricavato dall’opportuna tabella vale:
![]()
allora:
![]()
![]() questa variazione di entalpia è
direttamente rilevabile dalle tabelle in quanto rappresenta l’entalpia
differenziale del vapore acqueo saturo, detto anche calore latente di
vaporizzazione, e vale
questa variazione di entalpia è
direttamente rilevabile dalle tabelle in quanto rappresenta l’entalpia
differenziale del vapore acqueo saturo, detto anche calore latente di
vaporizzazione, e vale ![]() .
.
Allora avremo:
![]()
![]() questa è la variazione di
entalpia di un vapore surriscaldato che viene portato dalla temperatura
questa è la variazione di
entalpia di un vapore surriscaldato che viene portato dalla temperatura ![]() alla temperatura
alla temperatura ![]() ; anche in questo caso il salto di entalpia è pari al
prodotto del calore specifico per il salto di temperatura
; anche in questo caso il salto di entalpia è pari al
prodotto del calore specifico per il salto di temperatura
![]() (92)
(92)
dove ![]() è il calore specifico
a pressione costante medio tra i due estremi di temperatura del vapore; questo
si ricava dalle tabelle e vale:
è il calore specifico
a pressione costante medio tra i due estremi di temperatura del vapore; questo
si ricava dalle tabelle e vale:
![]()
per cui:
![]()
Allora sostituendo le
relazioni ottenute nella (90) otteniamo:
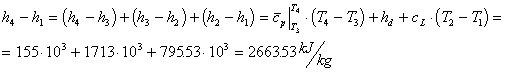
perciò:
![]()
e quindi:
![]()
ESERCIZIO:DETERMINAZIONE DEL
TITOLO
Si consideri un tubo dentro il
quale scorre del vapore acqueo sauro; utilizzando un manometro è possibile
rilevare la pressione all’interno del tubo, la quale vale ![]() . Determinare il titolo
. Determinare il titolo ![]() del vapore.
del vapore.
Soluzione:
Dai dati del problema deduciamo che il tubo costituisce un sistema
aperto e quindi applichiamo la teoria vista precedentemente per ricavare il
titolo.
Sappiamo che il vapore
saturo nel tubo è a una pressione pari a ![]() , allora consultando la tabella, si ricava che la temperatura
vale
, allora consultando la tabella, si ricava che la temperatura
vale ![]() .
.
Per misurare il titolo del
vapore saturo bisogna procedere nel seguente modo: si pratica un foro sulla
superficie laterale del tubo, vi si applica una valvola; agendo sulla valvola è
possibile far fuoriuscire una certa quantità di vapore di cui andiamo a
misurare la temperatura con un termometro ottenendo un valore pari a ![]() .
.
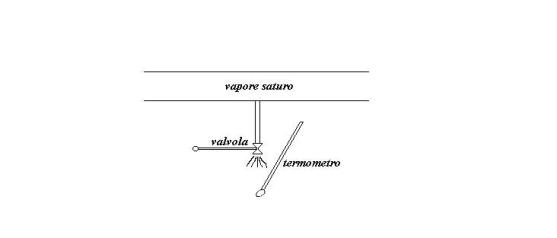
Fig. 15 – Schematizzazione
del sistema aperto
Ricordando che la pressione
atmosferica è pari a ![]() e che, a questa
pressione per il vapore acqueo saturo, i dati tabulati fanno corrispondere una
temperatura di
e che, a questa
pressione per il vapore acqueo saturo, i dati tabulati fanno corrispondere una
temperatura di ![]() si ha la seguente
situazione:
si ha la seguente
situazione:
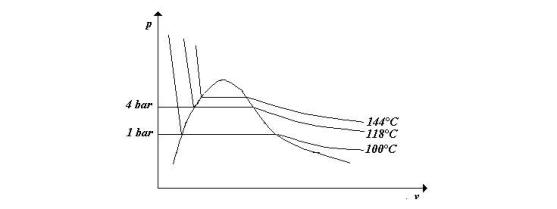
Fig. 16 – Diagramma
termodinamico dell’acqua
La trasformazione dello
stato 1, caratterizzato da ![]() e
e ![]() , allo stato 2, caratterizzato da
, allo stato 2, caratterizzato da ![]() e
e ![]() , è irreversibile e gli unici stati di equilibrio possibili
sono proprio lo stato iniziale e quello finale. Supponiamo che il vapore venga
fatto fuoriuscire dalla valvola attraverso un processo di laminazione, cioè
supponiamo che il vapore fuoriesca senza scambiare calore con l’ambiente e
supponiamo inoltre che quando il vapore esce sia in equilibrio di pressione con
l’atmosfera facendo sì che non vi sia scambio di lavoro in quanto non si ha
nessuna espansione.
, è irreversibile e gli unici stati di equilibrio possibili
sono proprio lo stato iniziale e quello finale. Supponiamo che il vapore venga
fatto fuoriuscire dalla valvola attraverso un processo di laminazione, cioè
supponiamo che il vapore fuoriesca senza scambiare calore con l’ambiente e
supponiamo inoltre che quando il vapore esce sia in equilibrio di pressione con
l’atmosfera facendo sì che non vi sia scambio di lavoro in quanto non si ha
nessuna espansione.
Siccome in questo sistema
non abbiamo né scambio di lavoro ![]() né scambio di calore
né scambio di calore ![]() , e supponendo che l’energia cinetica e l’energia potenziale
siano trascurabili, la relazione che descrive il bilancio di energia per un
sistema aperto si riduce a :
, e supponendo che l’energia cinetica e l’energia potenziale
siano trascurabili, la relazione che descrive il bilancio di energia per un
sistema aperto si riduce a :
![]() (93)
(93)
per cui:
![]() (94)
(94)
questo risultato indica che il tubo è un sistema
isoentropico.
Dalla teoria dei vapori
saturi sappiamo che:
![]() (95)
(95)
e che :
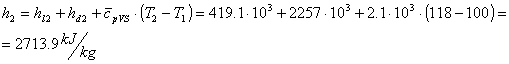 (96)
(96)
dove i valori dell’entalpia specifica del liquido, quella
differenziale e il calore specifico a pressione costante sono ricavabili dalle
tabelle.
Uguagliando le relazioni
(95) e (96) otteniamo:
![]()
per cui:
![]()
ricavando dalla tabella i valori mancanti:
![]()
![]()
otteniamo:
![]()