|
|
Corso di Fisica Tecnica |
|
|
Anno 2000-2001 |
||
|
Prof. ANGELO FARINA |
||
|
Facoltà di Ingegneria Università degli studi di Parma |
|
|
Corso di Fisica Tecnica |
|
|
Anno 2000-2001 |
||
|
Prof. ANGELO FARINA |
||
|
Facoltà di Ingegneria Università degli studi di Parma |
MISCELE DI ARIA E VAPORE ACQUEO
In questa lezioni analizziamo le miscele composte di aria e vapore acqueo soffermandoci sulle grandezze che definiscono l’umidità atmosferica e che ci aiutano a risolvere problemi sui condizionatori, impianti di aerazione, ecc… Vedremo in specifico anche strumenti di misura dell’umidità e anche alcuni problemi.
Aria: composizione e definizioni
Relazione tra il titolo e di grado idrometrico
Calore specifico medio a pressione costante
Entalpia specifica J in assenza di liquido
Strumenti per la misura dell’umidità
6) Igrometro di Assman (Psicrometro)
Problema1: Scatolone adiabatico
Appendice: Tabella del vapore
Tabella delle coordinate termodinamiche
Aria: composizione e definizioni
Nel linguaggio di tutti i giorni si parla di aria, intendendo appunto il gas in cui siamo immersi e respiriamo. Nelle applicazioni della fisica sono tre le definizioni principali usate per descrivere l’aria:
Aria atmosferica: contiene principalmente Azoto (N2) e Ossigeno (O2), e per il resto una miscela di altri gas, tra i quali anidride carbonica (CO2), vapore acqueo e varie sostanze inquinanti come polveri e fumi.
Aria Secca: per essa si intende l’aria atmosferica meno il vapore acqueo e le sostanze inquinanti. E’ costituita dal 78% di azoto, dal 21% di ossigeno, e restante 1% da altri gas, tra i quali l’anidride carbonica, l’elio, il neon e l’argon.
Aria Umida: è una miscela di Aria secca e vapore acqueo.
A causa della variabilità dell’aria atmosferica, in psicrometria è necessario distinguere tra aria secca e aria umida. Per gli usi pratici, l’aria umida e l’aria atmosferica possono essere considerate uguali nel campo delle condizioni normalmente incontrate.
La massa dell’aria può essere calcolata come la media pesata delle masse dei gas che la compongono, trascurando l’1% dei gas vari che è ininfluente.
Questa
risulta quindi : ![]() .
.
La massa
del vapore d’acqua invece, è la stessa dell’acqua (H2O) in quanto non
si tratta nient’altro che di acqua : ![]() .
.
Un vapore in genere non si comporta come un gas perfetto in quanto, in condizioni normali, il volume delle sue molecole non può essere considerato trascurabile: le deviazioni dalle leggi del gas ideale sono più sensibili per elevati valori della pressione ridotta e per bassi valori della temperatura ridotta. Tuttavia in certe condizioni anche un vapore saturo secco può essere considerato alla stregua di un gas perfetto: in tal caso, la miscela costituita dai gas inerti e dal vapore può essere considerata una miscela di gas perfetti e studiata termodinamicamente (come nel nostro caso).
Il comportamento delle miscele di soli gas differisce però da quello delle miscele di gas e vapore per un fatto fondamentale: mentre nelle prime è lecita e realizzabile qualunque combinazione ponderale, nelle seconde la presenza del vapore non può mai superare un determinato valore limite, dipendente solo dalla temperatura.
Conseguentemente nel primo caso si può modificare la temperatura del sistema e la composizione della miscela non cambia, mentre nel secondo caso una diminuzione di temperatura può portare a far condensare parte del vapore e quindi modificarne la composizione: se la miscela è in presenza di liquido, si ha una modifica anche per un aumento di temperatura, in quanto in tal caso vaporizza un ulteriore quantitativo di liquido.
Dalla tabella della coordinate termodinamiche (tabella 3) si deduce che le coordinate pseudocritiche della miscela valgono T = 132,8 K e P = 3,77 MPa: pertanto anche per temperature inferiori a 0°C l'aria secca può essere considerata un gas perfetto, purché la pressione non sia troppo elevata rispetto a quella atmosferica (0,1 MPa).
Il vapor d'acqua saturo è a sua volta caratterizzato dalla temperatura critica T = 647,3 K e dalla pressione critica P = 22,1 MPa : a valori della temperatura inferiori a 100 °C corrispondono pressioni di saturazione inferiori a 0,1 MPa e pertanto in tutto il campo di valori che interessano la tecnica anche il comportamento del vapor d'acqua è assimilabile a quello di un gas perfetto.
Quindi abbiamo trovato che la fase gassosa della miscela sarà considerata una miscela di due gas ideali, infatti il vapore presenta una pressione parziale molto piccola, quindi è lecito trascurare il comportamento da vapore surriscaldato. La composizione della fase gassosa potrà variare, per effetto di evaporazione o condensazione di acqua.
Quindi la massa di aria secca viene considerata costante (perché l’aria non si crea ne si distrugge a parte casi rari) mentre la massa di vapore cambia facilmente. Questo fatto spiega perché le grandezze specifiche non vengono riferite all’unità di massa della miscela, ma all’unità di massa dell’aria secca (si mantiene questa convenzione anche per compatibilità con il passato e per comodità). Ad esempio si parla di entalpia specifica definita come:
![]()
![]() ove Maria = massa dell’aria secca.
ove Maria = massa dell’aria secca.
L’aria che comunemente respiriamo è aria umida, la quantità di vapor acqueo presente nell’atmosfera è variabile, analizziamo ora un primo esperimento utile per comprendere questo fenomeno oltre che per trovare un sistema di misurazione della quantità di vapor acqueo nell’aria.
In presenza di aria inizialmente secca poniamo su una bilancia un recipiente contenente acqua mantenendo pressione P e temperatura T costanti (vedi figura 1)
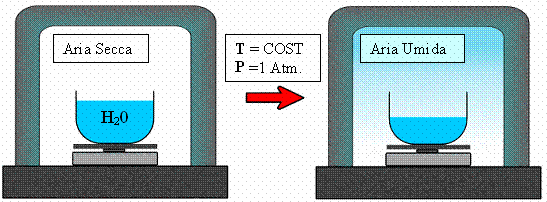 Fig. 1
Fig. 1
Dopo un certo periodo di tempo il livello di acqua nel contenitore sarà calato, cioè una certa massa di H2O sarà evaporata nell’aria , e il livello continuerà a calare sempre più lentamente fino a rimanere costante (quindi la bilancia misurerà una diminuzione della massa di acqua): il vapore formatosi si è disperso nella campana, trasformando l’aria secca in aria umida.
Questa esperienza mostra che se si mettono a contatto aria e acqua liquida , a temperatura e pressione costanti , l’acqua evapora fino a che la pressione parziale del vapore saturo eguaglia la pressione di saturazione dell’acqua alla temperatura T alla quale si opera.
In altri termini la presenza d’acqua non influisce sulla quantità di acqua che si volatilizza , ma soltanto sulla velocità del processo perché sia l'aria che il vapor d'acqua si comportano come gas perfetti e quindi la presenza dell'uno non interferisce con il comportamento dell'altro.
Visto che sia l’aria che il vapore possono essere considerati come gas perfetti, posso applicare la Legge di Dalton delle pressioni parziali:
![]()
dove ![]() è la pressione sotto la campana,
è la pressione sotto la campana, ![]() è la pressione dell’aria secca e
è la pressione dell’aria secca e ![]() è la pressione del vapore. Supponiamo di avere una bilancia
opportunamente tarata sotto al contenitore d’acqua, a questo punto possiamo
introdurre una nuova grandezza: il
è la pressione del vapore. Supponiamo di avere una bilancia
opportunamente tarata sotto al contenitore d’acqua, a questo punto possiamo
introdurre una nuova grandezza: il
Definito come:
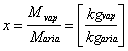 ( 1
)
( 1
)
Ove Mvap = massa di acqua evaporata
Maria= massa di aria secca
Kgvap = chilogrammi di vapore
Kgaria = chilogrammi di aria
Il titolo è il rapporto tra pesi di sostanze chimiche diverse e non si tratta quindi di un numero puro. Non va confuso con il titolo di vapore saturo che invece è un numero puro. Inoltre il titolo x non è confinato ad essere minore di 1 (ricordiamo che per il titolo di vapore saturo vale xvapore saturo < 1) ma può variare da 0 a ¥ .
Di solito per evitare semplificazioni dell’unità di misura, il titolo viene espresso in gvap /kg aria , dato che il vapore acqueo nell’aria umida è di solito presente in pochi grammi.
La grandezza che esprime quale è la massima massa di acqua che può volatilizzarsi in una massa di aria secca è il titolo di saturazione, cioè il titolo calcolato in condizioni di equilibrio tra aria e acqua in presenza di acqua liquida (in riferimento all’esperimento visto, il titolo calcolato quando il livello dell’acqua resta costante).
Il titolo di saturazione xsat è dipendente da temperatura e pressione:
xsat = xsat (p,t), ad esempio cresce al crescere della temperatura, quindi quando si parla di titolo di saturazione si considerano fissati i valori di questa due grandezze.
Solitamente si lavora in un sistema isobaro , a pressione atmosferica patm=1,013 bar quindi la dipendenza viene ad essere dalla sola temperatura.
I valori del titolo di saturazione riferiti alla pressione atmosferica in funzione della temperatura sono reperibili su apposite tabelle (vedi sezione tabelle).
Nell’esperimento l’evaporazione quindi continua fino a che il titolo (della miscela aria secca + vapore) non raggiunge il valore di saturazione. Il concetto che sia l’aria a saturarsi è sbagliato perché in realtà è l’acqua che si satura.
Il titolo x è un numero piccolo e preso a se stante non ci da una indicazione diretta del livello di saturazione del vapore acqueo nella miscela : per capire se l’aria sia secca o satura è necessario confrontare il titolo con quello di saturazione . Quindi si rende opportuno introdurre una nuova grandezza: il
Definito come :
![]() ( 2 )
( 2 )
Ove rv = massa del vapore acqueo nell’unità di volume della fase gassosa
rvsat = massa del vapore acqueo che sarebbe contenuto nell’unità di volume della fase gassosa in condizioni di saturazione.
Poichè per un gas ideale , a temperatura fissata , la densità è proporzionale alla pressione si ha anche , equivalentemente:
![]() ( 3 )
( 3 )
ove Pv = pressione parziale di vapore acqueo nella miscela
PvSat = pressione di vapore saturo secco
(fissata la temperatura T della miscela)
Il grado igrometrico può assumere valori compresi tra 0 e 1 , oppure in modo equivalente può essere espresso in percentuale: in tal caso prende il nome di umidità relativa.
La pressione del vapore saturo dipende unicamente dalla temperatura, e va ricavata dalle relative tabelle (tabella 1).
Per capire meglio cosa sia in pratica il grado igrometrico affidiamoci a questo esempio: consideriamo una massa d’aria umida alla temperatura T = 20°C. La pressione di saturazione ad una tale temperatura è PvSat = 23.31 mbar (questo valore è stato ricavato dalla Tabella 1) e la pressione parziale del vapore contenuto nella miscela è Pv = 16.317 mbar.
Il grado igrometrico si ricava dalla ( 3 ) sostituendo i valori numerici forniti:
![]() (o equivalentemente: Umidità relativa = 70%)
(o equivalentemente: Umidità relativa = 70%)
Questo significa che la miscela contiene il 70% della quantità di vapore che la renderebbe satura. Quindi il grado igrometrico j ci da una misura immediata di quanto l’aria sia effettivamente prossima alla saturazione.
Tuttavia il grado igrometrico presenta uno svantaggio: non indica in senso assoluto quanto vapore acqueo è contenuto nell’aria, ma piuttosto ci da’ un’idea di quanto l’aria sia distante dalla saturazione.
Consideriamo una miscela di aria e vapore acqueo , in assenza di liquido. Noto il grado igrometrico j vogliamo ricavare il titolo x relativo alla miscela.
Per le ipotesi precedentemente fatte , è lecito considerare aria e vapore acqueo come due gas perfetti. Quindi possiamo scrivere l’equazione di stato dei gas perfetti separatamente per la massa d’aria e la massa di vapore acqueo, considerando come volume a disposizione delle singole massa il volume totale. (questa assunzione discende dalla Legge di Dalton sulle miscele dei gas perfetti)
Quindi
Aria
![]() ( 4 )
( 4 )
Vapore
acqueo ![]() ( 5 )
( 5 )
Aria
![]() ( 8 )
( 8 )
Vapore
acqueo ![]() ( 9 )
( 9 )
Chiaramente la relazione (16) si può invertire, ottenendo il grado igrometrico in funzione del titolo (e della temperatura della massa d’aria analizzata), ottenendo
![]() (16b)
(16b)
dove le grandezze hanno lo stesso significato di prima. Occorre però fare una precisazione: il grado igrometrico può valere al massimo 1, quindi è necessario imporre questo vincolo quando si applica la formula di conversione (5). Se il risultato è superiore a 1, sicuramente i dati utilizzati non sono validi, ossia non siamo in una situazione reale.
Possiamo allora notare che il valore di x tale per cui j = 1, è proprio il titolo di saturazione. Per ogni particolare temperatura non è possibile che il titolo di una massa d’aria umida superi il titolo di saturazione (che varia in funzione di T).
|
Un fenomeno interessante legato a questi concetti è quello della nebbia. La nebbia si forma quando l’umidità relativa dell’aria è esattamente del 100% (ossia il titolo è pari a quello di saturazione). Si tratta di una situazione molto stabile, perché qualunque variazione della temperatura viene immediatamente controbilanciata dal comportamento dell’acqua. Supponiamo per esempio che la temperatura ambiente diminuisca: parte del vapore si condensa, producendo il calore latente di vaporizzazione, che va immediatamente a riscaldare l’ambiente. |
Definiamo il calore specifico della miscela cp, come la media pesata dei calori specifici dei componenti riferita alla massa di aria secca:
![]() ( 17 )
( 17 )
ove x = titolo della miscela
cparia = calore specifico dell’aria a pressione costante
cpvap = calore specifico del vapore acqueo a pressione costante
Questo risultato si ottiene dalla formula valida per le miscele dei gas perfetti:
 ( 18 )
( 18 )
ove cpi = calore specifico dell’i-esimo componente della miscela
Mi = massa dell’i-esimo componente della miscela
Dalla ( 18 ) il calore specifico medio cp’ si ricava come la media pesata dei calori specifici dei singoli componenti riferita alla massa totale della miscela .
Noi invece vogliamo riferire il calore specifico alla sola massa dell’aria secca M .
Quindi
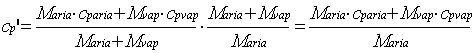 (19)
(19)
ed essendo
![]() ( 1 )
( 1 )
si ottiene la ( 17 ).
L’entalpia è una proprietà estensiva. Pertanto ,l’entalpia specifica j, cioè l’entalpia per chilogrammo di aria , sarà data dalla somma dell’entalpia di 1 Kg di aria e l’entalpia di X Kg di aria , dove X è il titolo della miscela ovvero il contenuto di vapore nell’aria.
Se siamo in assenza di acqua liquida ,sia l’aria sia l’acqua possono essere considerati gas ideali. Si adottano usualmente le seguenti convenzioni:
Per l’aria nelle condizioni di gas ideale, alla temperatura T=0° C l’entalpia specifica è h=0.
Per l’acqua alla temperatura T=0 °C l’entalpia specifica è h=0 per il liquido sulla curva limite inferiore. (Ricordiamo che in realtà la temperatura minima sulla curva limite inferiore è quella del punto triplo , ma spesso si approssima la temperatura del punto triplo dell’acqua con il valore 0 °C).
Con queste convenzioni si ha :
![]() ( 20 )
( 20 )
Cerchiamo una espressione della ( 20 ) con i valori numerici esplicitati.
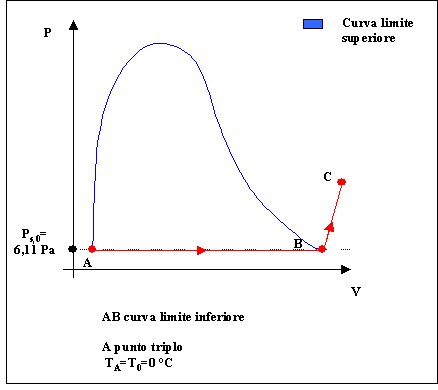
Fig. 2
Scriviamo l’equazione che descrive l’entalpia del vapore acqueo nel punto C:
![]() ( 21 )
( 21 )
Sapendo che :
1. la temperatura del punto A è quella del punto triplo TA=T0= 0 °C
2. r0 » 2500 KJ/Kg dove r0 ,calore latente di vaporizzazione dell’acqua a 0 °C, può essere ricavato dalle tabelle delle proprietà termodinamiche dell’acqua e del vapore saturo e corrisponde alla variazione di entalpia tra i punti A e B .
3. il calore specifico del vapore acqueo può essere assunto circa costante per temperature basse come quella ambiente : cpvap» 1,9 KJ/Kg.
Si ottiene:
![]() ( 22 )
( 22 )
dove tC è al temperatura espressa in gradi Celsius.
Dalla espressione dell’entalpia per i gas perfetti si ottiene:
![]() ( 23 )
( 23 )
ed essendo il calore specifico dell’aria cparia=1 KJ/Kg
![]() ( 24 )
( 24 )
Quindi sostituendo i valori ottenuti nella ( 20 ) si ricava:
![]()
![]() ( 25 )
( 25 )
Notiamo che la ( 25 ) è una formula dimensionalmente non omogenea , una formulazione più corretta ( che ha un significato fisico ) sarebbe :
![]() ( 26 )
( 26 )
Il diagramma psicrometrico è una rappresentazione grafica delle proprietà dell’aria in molte situazioni differenti. L’utilizzo di questo grafico è fondamentale nella progettazione di sistemi di ventilazione, sistemi per l’essiccamento dei cereali e perfino di umidificatori domestici.
Su tale diagramma sono indicati tre assi:
1. Asse x, verticale, posto nel margine destro, sul quale si possono leggere i valori del titolo della miscela in gvap/Kgaria;
2. Asse t, orizzontale, sul quale si possono leggere le temperature in °C.
3. Asse j posto diagonalmente nel margine sinistro, sul quale si possono leggere i valori dell’entalpia specifica in KJ/Kgariasecca .
Forniamo un esempio di diagramma psicrometrico ad una pressione pari a 1.013 Bar.
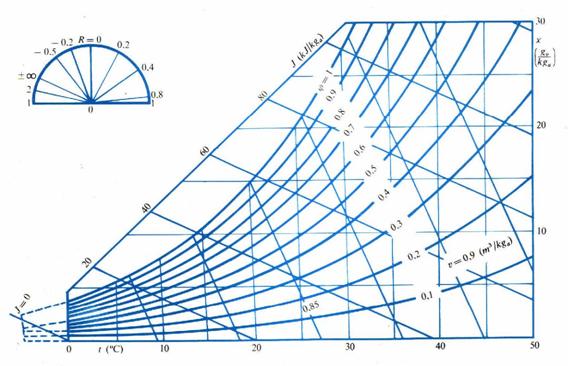
Fig. 3 Diagramma psicrometrico semplificato con le temperature e le rispettive umidità
A prima vista, anche un diagramma psicrometrico semplificato appare come un grafico molto complesso. Comunque, se si separano le varie linee, si capisce meglio la loro collocazione, il loro significato e come vanno usate.
Nel diagramma sono usate tre diverse misurazione della temperatura:
1. Temperatura del bulbo secco: è la temperatura dell’aria misurata con un normale termometro. La scala di questa temperatura è situata alla base del grafico. Le linee verticali indicano uguali temperature.
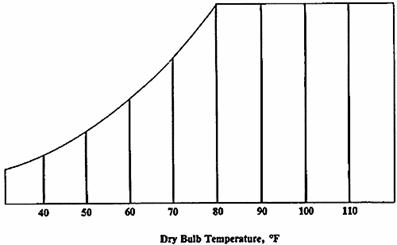
Fig. 4
2. Temperatura del bulbo umido: riflette l’effetto refrigerante dell’evaporazione dell’acqua. La temperatura può essere determinata facendo passare l’aria sopra un termometro che sia stato avvolto con un tessuto umido. L’effetto refrigerante dell’evaporazione dell’acqua causa un temperatura più bassa rispetto a quella del bulbo secco. La scala della temperatura del bulbo umido è situata lungo la retta in alto a sinistra nel grafico. Le linee inclinate indicano uguali temperature del bulbo umido.
· Le linee diagonali decrescenti, come si può facilmente dedurre dal diagramma, sono le curve isoentalpiche, l’entalpia specifica J viene misurata in KJ/kgaria.
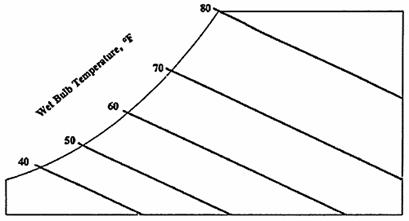
Fig. 5
4. Temperatura del punto di rugiada: è la temperatura al di sotto della quale l’umidità presente nell’aria condensa. L’aria che contiene più vapor acqueo possibile è satura oppure si trova al suo punto di rugiada. La scala della temperatura del punto di rugiada è localizzata lungo la stessa curva della scala della temperatura del bulbo umido. Tuttavia le linee orizzontali indicano uguali temperature del punto di rugiada.
STESSO TITOLO
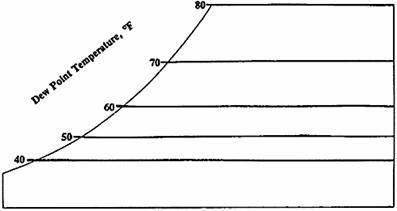
Fig. 6
Come suggerisce il nome, l’umidità relativa è una misura di quanta è presente nell’aria rapportata con quanta umidità l’aria può contenere al massimo a quella temperatura.
L’umidità relativa, che viene espressa in percentuale, è quella che viene data nelle previsioni meteorologiche. Le linee curve rappresentano condizioni di uguale umidità relativa e partono in basso a sinistra arrivando fino in alto a destra nel diagramma psicrometrico.
La linea del 100% di umidità relativa corrisponde alla scala delle temperature del bulbo umido e del punto di rugiada. La linea dello 0% di umidità relativa si trova invece lungo la scala della temperatura del bulbo secco.
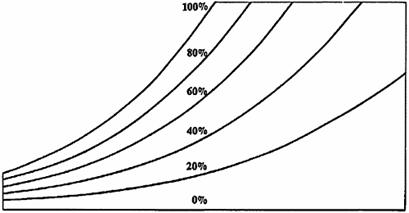
Fig. 7
Infine, sono anche disponibili semplici programmi che dati alcuni dati in ingresso, calcolano quelli mancanti e tutte le grandezze termodinamiche che descrivono lo stato dell’aria.
Ci sono anche linee diagonali decrescenti a coefficiente angolare superiore in modulo alle isoentalpiche, si tratta delle isocore, ovvero le linee a volume specifico costante e nel campo delle temperature che usualmente interessa la tecnica le curve isocore possano essere considerate rette parallele e come tali tracciate sul diagramma psicrometrico.
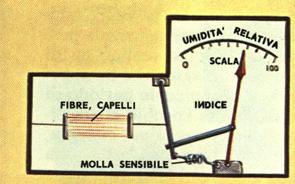
L’igrometro a capello è uno strumento di misura dell’umidità di comune utilizzo, ideato da Bassure alla fine del ‘700 (vedi figura). Nonostante questo non sia uno degli strumenti più precisi, viene ancora oggi utilizzato in alcune piccole stazioni meteorologiche meccaniche, ed all’interno di musei dove occorre monitorare costantemente l’umidità per preservare nel tempo le opere d’arte. Si basa su un semplice principio fisico: i capelli ed i peli di animali hanno la proprietà di accorciarsi all’aumentare del grado idrometrico (anche le ossa di balena nel caso dell’igrometro ad assorbimento di Meucci del 1876).
Al variare dell’umidità varia leggermente la lunghezza del fascio di capelli (composto da capelli e peli di vario tipo, in modo da migliorarne l’accuratezza), ciò implica che il fascio è sensibile anche al titolo e quindi è preciso ad una temperatura fissa (che normalmente è indicata sul quadrante contenente la scala graduata). La contrazione/allungamento provoca la rotazione della ruota dentata appoggiata al binario collocato al lato del fascio. La ruota più piccola amplifica la rotazione (si tratta di un moltiplicatore) e permette lo spostamento della lancetta che riferisce il valore di umidità relativa sulla scala graduata. Questo metodo non è eccessivamente preciso: la variazione di dimensione del fascio non è lineare, inoltre di norma la taratura che viene effettuata solo a 20°C, amplificando così quei comportamenti anomali al di fuori di questa temperatura. Questo strumento non si rivela molto preciso quindi e soprattutto, per valori molto bassi dell’umidità, mostra una notevole inerzia.

Uno strumento basato sullo stesso principio è l’igrografo: si ha quando al posto della scala graduata si trova un rullo di carta che ruota lentamente, ed al posto della lancetta un pennino; in questo modo i dati vengono registrati su carta quindi analizzabili in un secondo momento. In figura è rappresentato un esempio di centralina meteo con rullo che effettua un giro completo (solitamente in 24 ore oppure una settimana). Il rullo è visibile ma coperto da una vaschetta di plexiglas. I dati registrati sono tre: umidità, temperatura e pressione.
Questo tipo di strumenti si trova spesso in ambienti dove è necessario un
monitoraggio completo delle condizioni dell’ambiente, come per esempio in un
museo (dove valori di umidità o temperatura fuori norma potrebbero danneggiare
le opere d’arte). Esistono anche versioni elettroniche di queste centraline, più
comode in molti casi, ma le cui registrazioni non hanno valore legale (perché
facili da manomettere).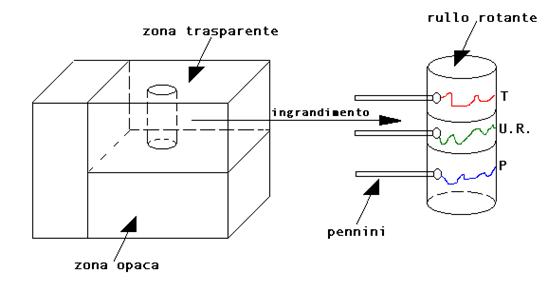




E’ uno dei metodi per la misura del grado igrometrico più semplice e antico (una particolare versione di questo sistema era già stata usata da Leonardo da Vinci). In figura è riportato proprio il progetto originale dell’inventore. Leonardo lo utilizzava come strumento per le previsioni meteorologiche, verificando le variazioni di umidità. Questo metodo si basa sull’evidenza fisica che certi materiali (come la bambagia, usata nel progetto originale), assorbono molto facilmente l’acqua presente nell’aria, di conseguenza aumentando di peso. Usando questo principio, il materiale scelto viene posto su uno dei piatti della bilancia e, terminata la misurazione, si verifica di quanto è aumentato il suo peso. La quantità ottenuta è semplicemente il valore della massa d’acqua assorbita, e conoscendo la massa d’aria oggetto della misura, si ottiene subito il titolo (e non il grado igrometrico, come nella maggior parte degli altri strumenti). Esiste una sua versione più moderna: è normalmente impiegato in laboratorio ed è utilizzato per misurare il grado di umidità dell’aria posta in tubo in impianti che utilizzano questo tipo di accorgimento.
Questo sistema è formato da un tubo, che viene allacciato alla linea da controllare, e da un contatore volumetrico a scatti per determinare il volume di aria in uscita. Il tubo possiede alle 2 estremità delle retine che permettono l’uscita dell’aria e trattengono i grani di materiale igroscopico (sali o acidi anidri (ad es. acido solforico)) che occorrono per la misura (vedi figura).
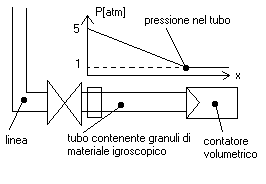
Il funzionamento è semplice: si allaccia il tubo alla linea così da permettere al contatore di registrare i metri cubi d’aria che escono dal dispositivo; una volta effettuata l’acquisizione si stacca il tubo e se ne misura il peso su di una bilancia: la differenza di peso del dispositivo rispetto a prima dell’operazione è il peso dell’acqua catturata dal sale anidro, che essendo in unità mista (g vapore/Volume di aria secca) va successivamente ridotta nel comune titolo o grado igrometrico, calcolo si può effettuare anche attraverso l’equazione di stato dei gas perfetti.
Questo sistema per la misurazione richiede cura strumentale e velocità (infatti il tubo potrebbe catturare aria dall’ambiente); è quindi un sistema che necessita, per il suo utilizzo, di una certa preparazione tecnica.


Questo strumento era di uso molto comune in passato, grazie alla sua discreta precisione e all’indipendenza dalla temperatura, ma oggi è quasi abbandonato per la difficoltà nella misura e perché ad ogni misura, prima dell’introduzione del diagramma psicrometrico, era necessario svolgere equazioni per ricavare le grandezze titolo oppure grado igrometrico desiderate. Forse derivato dall’igrometro di Crova (‘800 vedi figura), è composto da una vaschetta metallica aperta, dove sulla superficie esterna è posto il condensatore di una macchina frigorifera apposta (assomiglia ad una gelatiera) e un termometro, che fornisce la temperatura della vaschetta. Per effettuare la misura si lavora così: si misura la T iniziale, ossia la T ambiente Ta (la macchina frigorifera è inizialmente spenta). Dopo l’accensione la vaschetta comincia a raffreddarsi, ed è compito dell’addetto segnare la temperatura esatta in cui si appanna la vaschetta metallica. A questo punto, conoscendo le due T (iniziale e finale) e la pressione atmosferica, è facile risalire alle misure di titolo e umidità relativa. Vediamo cosa succede durante questa misurazione, lavorando con uno schema semplificato del diagramma psicrometrico (figura ).

L’istante iniziale è 1, a cui corrispondono una particolare temperatura (quella ambiente Ta), titolo e grado igrometrico. Man mano che il condensatore si raffredda, si percorre la linea rossa 1-2 (chiaramente il titolo non cambia, perché la quantità di aria e vapore d’acqua resta la stessa). Il punto 2 è il cosiddetto punto di rugiada, dove comincia ad avvenire la condensazione sulle pareti della vaschetta (si è in saturazione). A questa situazione corrisponde la temperatura di rugiada Tr. Il titolo (che resta costante durante tutta la trasformazione) è stato indicato come xsat, perché effettivamente si tratta del titolo di saturazione alla temperatura di rugiada misurata. Per conoscerne il valore basta applicare
![]() (14)
(14)
che deriva dalla (4) ponendo semplicemente j = 1, oppure leggendolo direttamente dalle tabelle. Ovviamente Psat(Tr) rappresenta la pressione di saturazione del vapore alla temperatura Tr (si legge sulle tabelle) e Ptot la pressione della massa d’aria oggetto della misura (eventualmente la pressione ambiente). Noto il titolo, è immediato ottenere il grado igrometrico iniziale, o estrapolandolo dal diagramma psicrometrico (bisogna verificare su quale curva a j costante giace il punto 1), oppure usando la
![]() (16b)
(16b)
che deriva immediatamente dalla (16).
Questo dispositivo ha una discreta precisione (1-2%) ed un costo piuttosto modesto rispetto ad altri strumenti di misurazione: viene ampiamente impiegato in ambito tecnico lavorativo ma limitatamente in laboratorio. Per una gran parte delle applicazioni di uso comune, l’igrometro elettronico è lo strumento ideale. I dati di tipo elettronico infatti sono facilmente trattabili e registrabili, e possono essere acquisiti da microprocessori, che comandano attuatori di vario tipo (ad esempi nei condizionatori d’aria, che a seconda del dato di umidità dell’ambiente, modificano il proprio modo di funzionamento). Può essere usato sia per misurazioni continue che discontinue.

L’igrometro elettronico è composto dal trasduttore e dal circuito di condizionamento.
Il resistore variabile (circondato in rosso) è il trasduttore: varia la propria resistenza in funzione dell’umidità. Così viene utilizzato per il condizionamento del segnale un ponte di Wheatstone, preferito grazie alla sua notevole sensibilità alla variazione di una delle resistenze sui suoi rami. Un schema semplice di ponte di Wheatstone è rappresentato in figura. Questo circuito ha la particolarità di imporre una tensione nulla sul voltmetro quando è bilanciato, ossia quando le resistenze sui quattro rami sono uguali. Quindi una piccola variazione della resistenza su un ramo (quello contenente il sensore), corrisponde ad una grande variazione di tensione sul voltmetro. In realtà, al posto del voltmetro può essere messo un qualsiasi circuito di condizionamento, per esempio un amplificatore seguito da un convertitore A/D che trasmette il segnale numerico ad un microprocessore (o microcontrollore) che lo analizza, lo registra o prende delle decisioni in base al valore acquisito.

Figura 1
L’analizzatore (due esempi sono visibili qui a fianco) è una sorta di fisarmonica, con uno o più buchi su un lato, di circa 1 cm di diametro e 15 cm di profondità, che possono ospitare ciascuno una speciale fialetta. Premendo l’analizzatore (proprio come una fisarmonica) si forza una quantità fissa e nota di aria (per molti modelli sono 100cm3) ad entrare nella fialetta. A questo punto le sostanze chimiche contenute in quest’ultima reagiscono con l’aria cambiando colore proporzionalmente alla grandezza da misurare. Le fialette stesse sono graduate, in modo renderne immediata la lettura.

La Drager produce fialette di diverso tipo, ciascuna in grado di effettuare una misura differente. Vi sono fialette per la misura del grado igrometrico, altre capaci di verificare la presenza di gas tossici o infiammabili, altre ancora per l’analisi del livello di radioattività. Nella figura a fianco sono visibili alcuni esempi di fialetta (già usati). Questo metodo di misura ha innegabili vantaggi di praticità e semplicità d’uso, oltre ad essere piuttosto economico se il numero di misure da effettuare è limitato. E’ per questo che l’analizzatore Drager è utilizzato correntemente dai vigili del fuoco, per esempio per le analisi dell’aria in ambienti potenzialmente contaminati. Lo svantaggio è che le fiale (oltre ad avere un tempo di vita limitato) sono usa e getta (dopo la rottura delle due chiusure laterali vanno usate immediatamente, e terminata la misura diventano inutilizzabili), quindi se le misure da effettuare sono tante, può essere più conveniente uno strumento con un più basso costo di mantenimento.


Noto anche come psicrometro, è costituito essenzialmente da due termometri a mercurio con i bulbi calati entro due brevi tratti di condotto attraverso i quali passa velocemente l'aria ambiente, richiamata da una ventola mossa da un meccanismo ad orologeria. Il bulbo di uno dei due termometri viene lambito direttamente dall'aria (TA), l'altro bulbo è ricoperto da una garza bagnata che lo mantiene costantemente coperto da un velo d'acqua (TB). Se l'aria che passa sopra il bulbo umido non è satura, essa tende ad arricchirsi di vapore e quindi produce la vaporizzazione dell'acqua trattenuta dalla garza: tale vaporizzazione avviene inizialmente a scapito di calore latente di vaporizzazione r dell'acqua stessa, che quindi si raffredda. A regime, si stabilisce tra aria ed acqua una differenza di temperatura che è tanto più grande quanto più secca è l'aria: in tali condizioni si instaura un equilibrio tra calore fornito dall'aria all'acqua e quantità di acqua evaporata.
Grazie a queste misurazioni è possibile conoscere titolo e grado igrometrico dell’aria in ingresso.
Per calcolare le relazioni matematiche che legano le diverse grandezze, consideriamo che, per un chilogrammo di aria secca,
![]() (27)
(27)
dove il segno meno sta a indicare che si è avuta una diminuzione dell’entalpia dell’aria, a causa dell’evaporazione di parte dell’acqua liquida presente nella garza, ma d’altra parte
![]() (28)
(28)
e da queste segue
![]() (29)
(29)
dove x rappresenta il titolo dell’aria umida. Si nota che la pendenza della funzione x(T) appena trovata è uguale a quella di una curva a entalpia costante, la cui pendenza approssimata è stata calcolata in (16).
Rappresentiamo quindi il funzionamento dell’igrometro di Assman sul diagramma psicrometrico, sapendo di doverci muovere su una curva di entalpia costante (approssimazione perfettamente accettabile).

Il punto B è di rugiada, si trova cioè sulla linea di grado igrometrico 1. Nota la temperatura TB (che viene anche detta temperatura di bulbo bagnato) quindi è noto immediatamente anche il punto B (intersezione tra la retta verticale corrispondente alla temperatura TB e curva a grado igrometrico costantemente 1). Nota anche TA, il punto A è data dall’intersezione tra la curva a entalpia costante passante per B e la retta verticale corrispondente alla temperatura TA. Noto anche il punto A, basta leggerne dal grafico il grado igrometrico e il titolo corrispondenti per conoscere i dati di umidità dell’aria in esame.
Concludendo, oltre al modello appena analizzato esiste anche una particolare versione di psicrometro elettronico, dotato di trasduttori di temperatura che trasmettono i dati rilevati a un apposito microcontrollore, che fornisce direttamente i risultati dell’analisi. Si tratta forse dello strumento di misura dell’umidità più efficiente e preciso (ma è anche molto costoso).
Un’altro
metodo, forse più pratico, di utilizzare lo psicrometro è, calcolare la
differenza tra la temperatura del bulbo secco e quella del bulbo umido e quindi
determinare l'umidità relativa utilizzando la tabella psicrometrica (Vedi
sezione tabelle).
Se ad esempio abbiamo una temperatura al bulbo umido di 25 gradi C° e 30 gradi C° al bulbo secco, la differenza di temperatura sarà di 5 gradi C°. Applicando i numeri 25 (bulbo umido) e 5 (differenza temperature dei due bulbi) alla tabella psicrometrica, facilmente determineremo che l'umidità dell'aria è del 65%.
PROBLEMA 1: Scatolone adiabatico ( isolato termicamente)
Si tratta del solito scatolone composto da due vani separati termicamente, A e B; tra di loro e dall’esterno, in ognuno dei due vani è contenuta una certa quantità di miscela di aria secca e vapore acqueo. Le due miscele si mischiano quando viene tolto il setto che separa i due vani tra di loro: dei due si ottiene un nuovo vano. Ecco le caratteristiche della miscela per ognuno dei due vani:
A® ![]()
![]()
![]()
B® ![]()
![]()
![]()

Togliendo il setto ci interessano le caratteristiche della nuova miscela:
F® ![]()
![]()
![]()
Utilizzando la ‘terza’ espressione dell’equazione di stato dei gas perfetti ottengo:
![]() che ci porta a:
che ci porta a: ![]() dove
dove ![]()
Ora per trovare le
pressioni dell’aria in A ed in B, faccio un bilancio delle pressioni sostituendo
poi nella formula quella del grado igrometrico (indico con ![]() le pressioni di vapore saturo secco)
le pressioni di vapore saturo secco)
![]()
Assumiamo la ![]() e le pressioni di vapore saturo le trovo in funzione della
temperatura nella tabella 1:
e le pressioni di vapore saturo le trovo in funzione della
temperatura nella tabella 1: ![]() e
e ![]() , quindi ottengo:
, quindi ottengo:
![]()
![]()
Da cui, convertendo tutto nel S.I. , ovvero i gradi da Centigradi in Kelvin e i bar in Pascal:
![]()
![]()
Sommando le due masse di aria di A e B ottengo subito la massa d’aria finale:
![]()
Ora ricavo i due
titoli in A e B con la relazione tra x e ![]() : formula (16)
: formula (16) ![]() , quindi:
, quindi:
![]()
![]()
Ora bilanciando le
masse del vapore ho ![]() , però
, però ![]() e quindi:
e quindi:
![]() che mi porta alla formula del titolo finale:
che mi porta alla formula del titolo finale:
![]()
Così come con i titoli ora agisco con le entalpie specifiche con la formula (25)
![]() :
:
![]() ,
,![]()
Ora dato che l’entalpia è una proprietà estensiva e che non c’è variazione di entalpia:
![]()
![]()
Ora basta invertire la formula dell’entalpia per ottenere:
![]() da cui
da cui ![]()
Ora da ![]() posso ricavare, grazie alla tabella 1
posso ricavare, grazie alla tabella 1 ![]()
Mi basta quindi sostituire nell’ultima formula, la (16b) (rapporto fra titolo e grado igrometrico):
![]() da cui ricavo:
da cui ricavo: ![]()
![]()
Ecco così trovate le caratteristiche della nuova miscela:
![]()
![]()
PROBLEMA 2: Miscelatore (miscelazione in un sistema aperto)

Si tratta di un componente adiabatico e meccanicamente isolato (Q=0, L=0). Dai tubi 1 e 2 entrano due diverse correnti di aria umida, che escono miscelate da 3. Note le caratteristiche delle correnti in 1 e 2, trovare quelle in 3.
1®
![]()
![]()
![]()
2®
![]()
![]()
![]()
Essendo in condizioni di regime stazionario, abbiamo
![]()
mentre facendo il bilancio di massa del vapore acqueo
![]()
ma x1 e x2 possono essere facilmente determinati con la (16) (per ciascuna corrente è nota la temperatura e il grado igrometrico)
![]()
dove il valore di 0,04753 è ottenuto dalle tabelle del vapore. Analogamente
![]()
di conseguenza troviamo immediatamente il valore del titolo della corrente d’uscita

A questo punto ho definito due punti ben precisi sul diagramma psicrometrico e la soluzione cercata si trova sulla congiungente dei due punti. Ragionando a spanne potremmo dire che la soluzione è il punto di media pesata (rispetto alla massa) dei i punti 1 e 2. Continuiamo però con una soluzione più rigorosa, effettuando il bilancio dell’energia
![]()
dove Ji rappresenta l’entalpia specifica dell’aria nel punto i-esimo (e MAi la relativa portata in massa). Il lavoro e il calore scambiati sono nulli, per le ipotesi di adiabaticità e isolamento meccanico del miscelatore fatte all’inizio dell’esercizio. Dalla formula precedente si ottiene
![]()
e, calcolando J1 e J2 usando la (25) otteniamo
![]()
e analogamente
![]()
quindi

A questo punto invertiamo la (25) per ottenere la temperatura dell’aria miscelata
![]()
controlliamo le tabelle del vapore per conoscere il valore della pressione di saturazione alla temperatura appena ottenuta
![]()
e applicando la (16b)
![]()
Infine visualizziamo i dati relativi alle 3 correnti sul diagramma psicrometrico

Come si vede dalla Figura 4, le caratteristiche della corrente uscente sono una combinazione lineare delle caratteristiche della corrente entrante.
|
Un interessante fenomeno che si può facilmente comprendere dal diagramma psicrometrico e dalla trattazione del precedente esercizio è la pioggia. Supponiamo che due correnti umide con lo stesso grado igrometrico ma diversa temperatura vengano a contatto: l’aria risultante dalla miscelazione avrà temperatura e titolo compresi tra i corrispondenti valori delle correnti iniziali. Il grado igrometrico invece è più alto dell’originale. Questo fatto apparentemente strano si spiega matematicamente osservando che le curve a grado igrometrico costante sono convesse, di conseguenza ogni segmento congiungente due punti qualunque di una curva, sta sopra la curva stessa.
Figura 18 Quando nel cielo due correnti molto umide, una fredda e una calda, si scontrano, può succedere che la corrente risultante abbia grado igrometrico maggiore di 1, in questo caso parte del vapore si condensa e avviene il fenomeno della pioggia. Perché piova quindi non basta che l’aria ad alta quota sia umida, ma è necessario lo scontro tra masse d’aria di temperatura diversa. Stesso discorso è per le
scie degli aerei: i gas di scarico degli aeroplani sono miscele
incandescenti che contengono una grande quantità di vapore acqueo;
quando questo vapore viene a contatto con l'aria gelida delle alte quote
si condensa immediatamente, formando la tipica scia di
condensazione. |
Un condizionatore d’aria è un componente in grado di modificare i parametri di temperatura e grado igrometrico di una corrente d’aria calda iniziale, che viene trasformata in una corrente più fredda e secca all’uscita.

Un
condizionatore (vedi figura) in generale è composto da 4 elementi fondamentali.
Innanzitutto una ventola, che facilità l’afflusso d’aria, e in figura è
rappresentata da una potenza ![]() entrante. Immediatamente dopo l’aria incontra una serpentina
di raffreddamento (per esempio il condensatore di una macchina frigorifera) che
le sottrae una calore per unità di tempo
entrante. Immediatamente dopo l’aria incontra una serpentina
di raffreddamento (per esempio il condensatore di una macchina frigorifera) che
le sottrae una calore per unità di tempo ![]() , in modo da portarla alla temperatura di rugiada. Le alette
che si trovano subito dopo hanno il compito di raccogliere la condensa formatasi
a causa del raffreddamento (vedi diagramma psicrometrico più sotto), formando
acqua che viene incanalata in un tubicino (e poi scaricata oppure raccolta in
bottiglioni per essere usata come acqua distillata). L’aria nel punto 2 è satura
e troppo fredda per essere immessa in un ambiente (perché la condensazione
richiede calore per avvenire, che viene sottratto dalla corrente d’aria), quindi
passa attraverso l’ultima sezione del condizionatore, chiamata di
post-riscaldamento, che fornendo il calore per unità di tempo
, in modo da portarla alla temperatura di rugiada. Le alette
che si trovano subito dopo hanno il compito di raccogliere la condensa formatasi
a causa del raffreddamento (vedi diagramma psicrometrico più sotto), formando
acqua che viene incanalata in un tubicino (e poi scaricata oppure raccolta in
bottiglioni per essere usata come acqua distillata). L’aria nel punto 2 è satura
e troppo fredda per essere immessa in un ambiente (perché la condensazione
richiede calore per avvenire, che viene sottratto dalla corrente d’aria), quindi
passa attraverso l’ultima sezione del condizionatore, chiamata di
post-riscaldamento, che fornendo il calore per unità di tempo ![]() scalda l’aria e la rende adatta ad essere immessa
nell’ambiente, come nel punto 3.
scalda l’aria e la rende adatta ad essere immessa
nell’ambiente, come nel punto 3.

Vediamo cosa succede all’aria, identificando tutte le fasi di trasformazione sul diagramma psicrometrico. All’ingresso del condizionatore (punto 1) l’aria è calda (temperatura T1) e umida. A contatto con la griglia di raffreddamento le viene sottratto il calore Q1, quindi raffredda fino al punto 1’ (il titolo x1 rimane costante perché le masse di aria secca e vapore restano costanti), poi comincia la condensazione accompagnata da un notevole raffreddamento fino al punto 2, con temperatura T2 (come si può vedere l’entalpia specifica della massa d’aria cala rapidamente). Inoltre anche il titolo cala (al valore x2), perché una parte del vapore d’acqua condensa mentre la massa d’aria secca resta costante (evidentemente quindi il rapporto MV/MA scende), mentre il grado igrometrico rimane costantemente 1 (aria umida satura). A questo punto l’aria molto fredda viene post-riscaldata fornendole un calore Q2, portandosi a una temperatura T3 superiore, mentre il nuovo valore del titolo resta costante (x2 = x3) ma cala l’umidità relativa.
Dapprima possiamo facilmente calcolare il titolo dell’aria in ingresso (x1) come nell’esercizio precedente, quindi
![]()
e analogamente per il titolo dell’aria in uscita
![]()
D’altra parte l’aria secca è un gas perfetto, quindi
![]()
e
![]()
![]()
che rappresenta la portata in massa di aria secca
in uscita (che equivale a quella di ingresso ![]() ). Possiamo quindi facilmente trovare la portata in massa
dell’acqua condensata, come:
). Possiamo quindi facilmente trovare la portata in massa
dell’acqua condensata, come:
![]() A questo punto facciamo il bilancio energetico della prima
parte del condizionatore (comprendente i punti 1 e 2), ottenendo
A questo punto facciamo il bilancio energetico della prima
parte del condizionatore (comprendente i punti 1 e 2), ottenendo
![]()
dove hl rappresenta l’entalpia
specifica dell’acqua liquida in fase di condensazione. La temperatura di
quest’ultima può essere estrapolata dal diagramma psicrometrico oppure dalle
tabelle dell’aria satura, ottenendo ![]()
(in realtà dalle tabelle si otterrebbe un valore del titolo, per aria satura alla temperatura di 10°C, pari a 0,00762 kgV/kgA contro i 0,0074 kgV/kgA del nostro caso, quindi con un errore ancora accettabile).
A questo punto calcoliamo le entalpie specifiche dell’aria in 1, 2 e 3, ottenendo
![]()
![]()
![]()
mentre l’entalpia specifica dell’acqua liquida condensata
![]()
di conseguenza sostituendo nell’equazione di bilancio energetico otteniamo
![]()
dove il segno meno sta ad indicare che è un calore uscente dal sistema (sottratto dall’aria) mentre il lavoro è negativo perché effettuato sul sistema.
Infine, scrivendo l’equazione di bilancio
energetico per la seconda parte del condizionatore (punti 2-3) otteniamo ![]()
che rappresenta il calore che deve essere fornito alla batteria di post-riscaldamento.
Appendice
|
Temperatura dell’aria T °C |
Pressione di vapore dell’aria satura P mbar P mmHg
|
Titolo di saturazione x g/Kg |
|
|
-20 |
1.02 |
0.756 |
0.63 |
|
-19 |
1.13 |
0.848 |
0.7 |
|
-18 |
1.25 |
0.938 |
0.77 |
|
-17 |
1.37 |
1.028 |
0.85 |
|
-16 |
1.5 |
1.125 |
0.93 |
|
-15 |
1.65 |
1.238 |
1.01 |
|
-14 |
1.81 |
1.358 |
1.11 |
|
-13 |
1.98 |
1.485 |
1.22 |
|
-12 |
2.17 |
1.628 |
1.34 |
|
-11 |
2.37 |
1.778 |
1.46 |
|
-10 |
2.59 |
1.943 |
1.6 |
|
-9 |
2.83 |
2.123 |
1.75 |
|
-8 |
3.09 |
2.318 |
1.91 |
|
-7 |
3.36 |
2.520 |
2.08 |
|
-6 |
3.67 |
2.753 |
2.27 |
|
-5 |
4 |
3 |
2.49 |
|
-4 |
4.36 |
3.270 |
2.69 |
|
-3 |
4.75 |
3.563 |
2.94 |
|
-2 |
5.16 |
3.870 |
3.19 |
|
-1 |
5.61 |
4.208 |
3.47 |
|
0 |
6.09 |
4.568 |
3.78 |
|
1 |
6.56 |
4.920 |
4.07 |
|
2 |
7.04 |
5.280 |
4.37 |
|
3 |
7.57 |
5.678 |
4.7 |
|
4 |
8.11 |
6.083 |
5.03 |
|
5 |
8.7 |
6.526 |
5.4 |
|
6 |
9.32 |
6.991 |
5.79 |
|
7 |
9.99 |
7.493 |
6.21 |
|
8 |
10.7 |
8.026 |
6.65 |
|
9 |
11.46 |
8.596 |
7.13 |
|
10 |
12.25 |
9.188 |
7.63 |
|
11 |
13.09 |
9.818 |
8.15 |
|
12 |
13.99 |
10.493 |
8.75 |
|
13 |
14.94 |
11.206 |
9.35 |
|
14 |
15.95 |
11.963 |
9.97 |
|
15 |
17.01 |
12.759 |
10.6 |
|
16 |
18.13 |
13.599 |
11.4 |
|
17 |
19.32 |
14.491 |
12.2 |
|
18 |
20.59 |
15.444 |
12.9 |
|
19 |
21.92 |
16.441 |
13.8 |
|
20 |
23.31 |
17.484 |
14.7 |
|
21 |
24.8 |
18.602 |
15.6 |
|
22 |
26.37 |
19.779 |
16.6 |
|
23 |
28.02 |
21.017 |
17.7 |
|
24 |
29.77 |
22.3 |
18.8 |
|
25 |
31.6 |
23.702 |
20 |
|
26 |
33.53 |
25.150 |
21.4 |
|
27 |
35.56 |
26.672 |
22.6 |
|
28 |
37.71 |
28.285 |
24 |
|
29 |
39.95 |
29.965 |
25.6 |
|
30 |
42.32 |
31.748 |
27.2 |
|
31 |
44.82 |
33.618 |
28.8 |
|
32 |
47.46 |
35.575 |
30.6 |
|
33 |
50.18 |
37.638 |
32.5 |
|
34 |
53.07 |
39.806 |
34.4 |
|
35 |
56.1 |
42.078 |
36.6 |
|
36 |
59.26 |
44.449 |
38.8 |
|
37 |
62.6 |
46.954 |
41.1 |
|
38 |
66.09 |
49.572 |
43.5 |
|
39 |
69.75 |
51.317 |
46 |
|
40 |
73.58 |
55.198 |
48.8 |
|
41 |
77.59 |
58.197 |
51.7 |
|
42 |
81.8 |
61.355 |
54.8 |
|
43 |
86.18 |
64.64 |
58 |
|
44 |
90.79 |
68.098 |
61.3 |
|
45 |
95.6 |
71.706 |
65 |
|
46 |
100.61 |
75.464 |
68.9 |
|
47 |
105.87 |
79.409 |
72.8 |
|
48 |
111.33 |
83.504 |
77 |
|
49 |
117.07 |
87.81 |
81.5 |
|
50 |
123.04 |
92.288 |
86.2 |
|
55 |
150.94 |
117.715 |
114 |
|
60 |
198.7 |
149.037 |
152 |
|
65 |
249.38 |
187.05 |
204 |
|
70 |
310.82 |
233.134 |
276 |
|
75 |
384.5 |
288.398 |
382 |
|
80 |
472.28 |
354.239 |
545 |
|
85 |
576.69 |
432.553 |
828 |
|
90 |
699.31 |
524.525 |
1400 |
|
95 |
834.09 |
625.618 |
3120 |
|
100 |
1013 |
759.812 |
- |
|
T° del bulbo umido |
Differenza tra le temperature dei due bulbi |
|||||||||||
|
1/2 |
1 |
11/2 |
2 |
21/2 |
3 |
31/2 |
4 |
41/2 |
5 |
51/2 |
6 |
|
|
2 |
90 |
83 |
75 |
67 |
61 |
54 |
47 |
42 |
36 |
31 |
26 |
23 |
|
3 |
90 |
83 |
76 |
69 |
63 |
56 |
49 |
44 |
39 |
34 |
29 |
26 |
|
4 |
91 |
84 |
77 |
70 |
64 |
57 |
51 |
46 |
41 |
36 |
32 |
28 |
|
5 |
91 |
85 |
78 |
71 |
65 |
59 |
54 |
48 |
43 |
39 |
34 |
30 |
|
6 |
92 |
85 |
78 |
72 |
66 |
61 |
56 |
50 |
45 |
41 |
35 |
33 |
|
7 |
92 |
86 |
79 |
73 |
67 |
62 |
57 |
52 |
47 |
43 |
39 |
35 |
|
8 |
92 |
86 |
80 |
74 |
68 |
63 |
58 |
54 |
49 |
45 |
41 |
37 |
|
9 |
93 |
86 |
81 |
75 |
70 |
65 |
60 |
55 |
51 |
47 |
43 |
39 |
|
10 |
94 |
87 |
82 |
76 |
71 |
66 |
61 |
57 |
53 |
48 |
45 |
41 |
|
11 |
94 |
88 |
82 |
77 |
72 |
67 |
62 |
58 |
55 |
50 |
47 |
43 |
|
12 |
94 |
88 |
82 |
78 |
73 |
68 |
63 |
59 |
56 |
52 |
48 |
44 |
|
13 |
94 |
89 |
83 |
78 |
73 |
69 |
64 |
61 |
57 |
53 |
50 |
46 |
|
14 |
94 |
89 |
83 |
79 |
74 |
70 |
66 |
62 |
58 |
54 |
51 |
47 |
|
15 |
94 |
89 |
84 |
80 |
75 |
71 |
67 |
63 |
59 |
55 |
52 |
49 |
|
16 |
95 |
90 |
84 |
80 |
75 |
72 |
67 |
64 |
60 |
57 |
53 |
50 |
|
17 |
95 |
90 |
84 |
81 |
76 |
73 |
68 |
65 |
61 |
58 |
54 |
52 |
|
18 |
95 |
90 |
85 |
81 |
76 |
74 |
69 |
66 |
62 |
59 |
56 |
53 |
|
19 |
95 |
91 |
85 |
82 |
77 |
74 |
70 |
66 |
63 |
60 |
57 |
54 |
|
20 |
95 |
91 |
86 |
82 |
78 |
75 |
71 |
66 |
64 |
61 |
58 |
55 |
|
21 |
95 |
91 |
86 |
83 |
79 |
75 |
71 |
68 |
65 |
62 |
59 |
56 |
|
22 |
95 |
91 |
87 |
83 |
79 |
76 |
72 |
69 |
65 |
63 |
60 |
57 |
|
23 |
96 |
91 |
87 |
83 |
80 |
76 |
72 |
69 |
66 |
63 |
61 |
58 |
|
24 |
96 |
92 |
88 |
84 |
80 |
77 |
73 |
70 |
67 |
64 |
62 |
59 |
|
25 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
70 |
68 |
65 |
63 |
59 |
|
26 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
71 |
68 |
65 |
63 |
59 |
|
27 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
71 |
68 |
65 |
63 |
59 |
|
28 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
71 |
68 |
65 |
63 |
60 |
|
29 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
72 |
69 |
66 |
63 |
60 |
|
30 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
69 |
66 |
64 |
60 |
|
31 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
69 |
66 |
64 |
61 |
|
32 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
64 |
61 |
|
33 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
64 |
62 |
|
34 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
65 |
62 |
|
35 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
65 |
62 |
|
36 |
98 |
94 |
90 |
86 |
83 |
79 |
76 |
73 |
71 |
68 |
65 |
63 |
|
37 |
98 |
94 |
90 |
86 |
83 |
79 |
76 |
73 |
71 |
68 |
66 |
63 |
|
38 |
98 |
94 |
90 |
86 |
83 |
79 |
76 |
73 |
71 |
68 |
66 |
63 |
|
39 |
98 |
94 |
90 |
87 |
83 |
80 |
77 |
74 |
72 |
69 |
67 |
64 |
|
40 |
98 |
95 |
90 |
87 |
83 |
80 |
77 |
74 |
72 |
69 |
67 |
64 |
|
Gas |
Temperatura Critica [°K]
Tc |
Pressione Critica [105Pa]
pc |
|
aria |
37,7 |
132,8 |
|
O2 |
50,7 |
154,4 |
|
N2 |
33,9 |
126,1 |
|
H2O |
221,2 |
647,3 |
|
CO |
34,9 |
132,8 |
|
CO2 |
73,8 |
304,4 |
|
NH3 |
112,7 |
405,6 |
|
H2 |
13,0 |
33,2 |
|
He |
2,29 |
5,18 |