Esercizi sui Gas Perfetti
Esercizio 1) Lo Scatolone Adiabatico
Per “scatolone adiabatico” si intende un recipiente rigido ed isolato
verso l’esterno. Nell’esercizio consideriamo uno scatolone adiabatico come in
Figura 1.
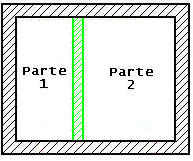
Fig. 1 – Lo Scatolone
Adiabatico.
Al suo interno vi è un setto rigido, isolato e di spessore trascurabile che divide il recipiente in due parti entrambe contenenti aria con le seguenti proprietà:
|
|
Volume |
Pressione |
Temperatura |
|
Parte 1 |
V1 = 1 m3 |
P1 = 1 BAR |
t1 = 100 °C |
|
Parte 2 |
V2 = 2 m3 |
P2 = 10 BAR |
t2 = 200 °C |
Le prime considerazioni
da fare sono che essendo il contenitore adiabatico è termicamente isolato, quindi
avrò Q = 0, inoltre, poiché si è detto che lo scatolone è rigido, sarà anche L
= 0.
Ad un certo istante il
setto viene rimosso in modo che le due quantità d’aria si mescolino (Figura 2).
Dopo un po’ il sistema tornerà in equilibrio. Indichiamo con V3, P3
e T3 le proprietà termodinamiche finali del sistema.

Fig. 2 – Stato finale del sistema.
Determinare V3, P3 e T3
Risoluzione
L’aria
può essere trattata come una sostanza pura anche se è una miscela di
gas, questo perché le caratteristiche chimiche dei singoli componenti che la
formano sono mediamente simili.
Si può quindi calcolare
la massa molare dell’aria
![]() (1)
(1)
E’ facile osservare che ![]() (2)
(2)
Ricordiamo l’enunciato
del Primo Principio della Termodinamica:
La variazione di energia interna di un sistema è uguale al lavoro compiuto sul sistema più il calore che vi si è trasferito.
![]() (3)
(3)
In questo caso si era notato che Q = 0 ed anche L = 0 quindi si avrà U = cost
Sfruttando questo ragionamento si può scrivere
![]() (4)
(4)
Da cui ricava
![]() Formula della media pesata (5)
Formula della media pesata (5)
E’ superfluo far notare che la massa M3 della miscela finale sarà pari ad M1+M2
Per ricavare le masse d’aria in gioco si usano le equazioni
di stato dei gas perfetti:
![]() (6)
(6)
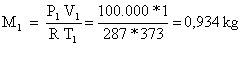 (7)
(7)
Essendo
![]() (8)
(8)
In questo caso
![]() (9)
(9)
Analogamente
![]() (10)
(10)
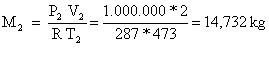 (11)
(11)
Essendo ![]() (12)
(12)
Con la formula della media pesata si ottiene
![]() (13)
(13)
![]() (14)
(14)
Per ricavare la pressione una volta noti il volume e la temperatura si usa di nuovo l’equazione dei gas perfetti:
![]() (15)
(15)
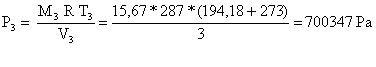 (16)
(16)
![]() (17)
(17)
Quesito: Cosa è successo all’entropia?
Si nota che la trasformazione è stata irreversibile. Il sistema aveva capacità di produrre lavoro, ma una volta tolto il setto questa capacità è diminuita.
La variazione di
entropia sarà quindi
maggiore di zero e
non essendoci scambi con
l’esterno sarà DSSISTEMA > 0
![]()
![]() (18)
(18)
![]()
![]() (19)
(19)
![]()
![]() (20)
(20)
![]() (21)
(21)
Esercizio 2) La Pompa da Bicicletta
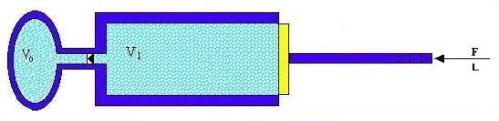
Fig. 3- Rappresentazione di una pompa da bicilcetta.
Si
tratta di un sistema formato da un recipiente da riempire d’aria compressa e da
uno stantuffo.
Agendo su quest’ultimo si introduce lavoro
meccanico L nel sistema.
Si consideri l’aria a condizioni standard:
Pressione P = 1 BAR
Temperatura T = 20 °C
Poiché
il processo di pompaggio è rapido si può supporre che non si abbia scambio di
calore con l’esterno, quindi si ha un processo adiabatico ![]() Q = 0
Q = 0
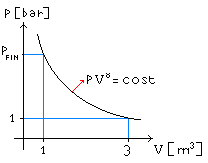
Fig. 4 – Rappresentazione grafica del processo
Determinare la temperatura TFIN e la pressione finale PFIN
a cui verrà portata l’aria dopo che lo stantuffo è stato abbassato
completamente (Figura 5).
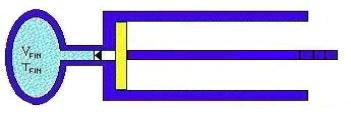
Fig. 5 – Stato finale del
sistema
Risoluzione:
![]() (22)
(22)
Si
deve trovare la massa della quantità d’aria in gioco. Applicando l’equazione di
stato P1 VTOT
= M R T1 si ottiene
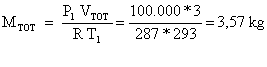 (23)
(23)
Poichè si ha una trasformazione adiabatica
reversibile vale l’equazione
![]() (24)
(24)
Essendo inoltre il sistema chiuso la massa non cambia quindi anzichè il
volume specifico si può considerare il
volume totale e l’equazione precedente diventa
![]() (25)
(25)
Si ottiene
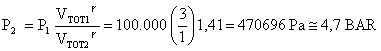 (26)
(26)
Dall’equazione di stato nello stato finale ![]() si
ottiene
si
ottiene
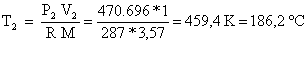 (27)
(27)
Quesito 1): Quanto lavoro si è speso nel processo?
Per calcolare il lavoro si può procedere in diversi modi:
1) Calcolando l’area
sottesa dal grafico di Figura 6
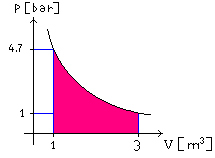
![]() (28)
(28)
Ricavando P dall’equazione ![]()
![]() e sostituendo.
e sostituendo.
2)
Usando il Primo Principio della Termodinamica: ![]()
Essendo il processo adiabatico non vi è alcuna quantità di calcore
scambiato per cui si avrà
![]() (29)
(29)
Quesito 2): Chi ha
fatto tutto questo lavoro?
Si noti che al di fuori del sistema c’è aria alla
pressione P1=P0
Quindi
agendo sullo stantuffo si deve vincere una pressione che è la differenza tra la
pressione interna e la presisone atmosferica esterna (frecce rosse di Figura 7)
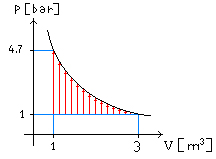
Fig 7
L’aria
esterna compie invece un lavoro pari all’area del rettangolo indicato in Figura
8
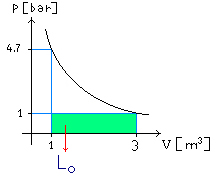
Fig.
8 – L0 = Lavoro compiuto
dall’aria esterna
![]() (30)
(30)
Il Lavoro netto svolto dall’operatore è quindi
![]() (31)
(31)
In
realtà la pompa è un sistema aperto: per ogni movimento ciclico dello
stantuffo, nel sistema entra materia attraverso una valvola di aspirazione e
poi viene espulsa attraverso la valvola di mandata.
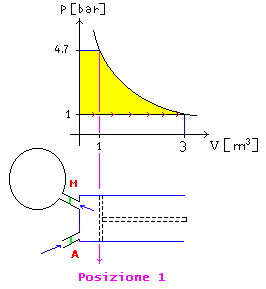
Fig. 9 –
Pompa come sistema aperto
Quando
lo stantuffo arriva nella posizione 1
la valvola di mandata “M” si apre e l’aria viene spinta nel pallone. Per
portare lo stantuffo nella posizione finale si dovrà però spendere ancora
lavoro. Per la mandata si è quindi compiuto un lavoro pari all’area gialla di
Figura 9.
Durante il ritorno (frecce rosse di Figura 9) lo stantuffo è a pressione
atmosferica e quindi sarà l’operatore che restituisce lavoro all’ambiente.
Se non
vi fosse stata pressione atmosferica il lavoro speso per la prima mandata era
il eguente
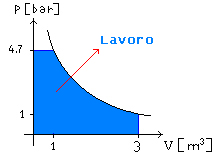
Fig.
10 – Lavoro speso durante la prima mandata in assenza di pressione esterna
Ma al ritorno
lo stantuffo sarebbe tornato da solo e quindi avrebbe restituito un lavoro pari all’area indicata in
Figura.11
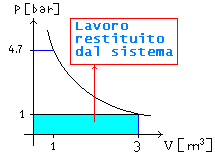
Fig. 11
Per calcolare il lavoro nei sistemi aperti si usa
quindi la formula
![]() (32)
(32)
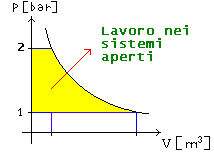
Fig. 12
Calcolo delle Proprietà dei Liquidi
Nel diagramma termodinamico (P,V) lo stato
liquido si trova nella regione tratteggiata di Figura 13
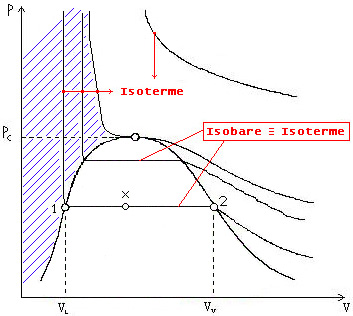
Fig. 13
Una
proprietà delle sostanze liquide è che il loro volume specifico è costante
(si notino le isoterme verticali del grafico di Figura 13)
Equazione di stato dei liquidi ![]() v = cost
(33)
v = cost
(33)
Per
variare il volume di un liquido si può agire variando la sua temperatura ma non
la pressione.
Per un
dato liquido i valori di volume specifico o densità ad una data temperatura
vengono riportati in grafici o tabelle (vedi Figure 14 e 15).
Ad un
dato valore di temperatura corrisponde un certo volume specifico che resta
costante al variare della pressione (isoterme verticali di Figura 13).
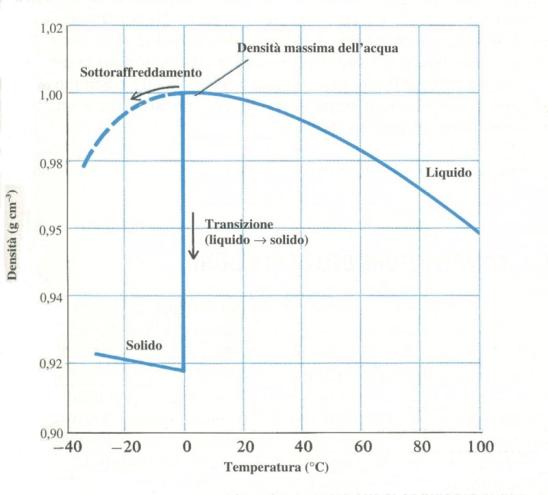
Fig. 14 – Andamento della densità
dell’acqua al variare della temperatura
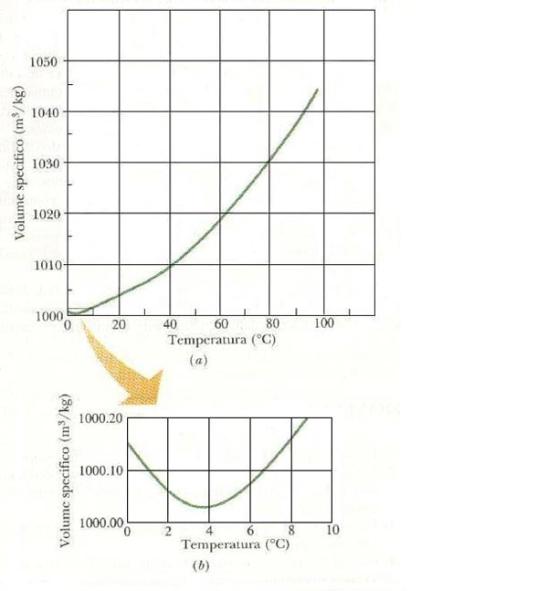
Fig. 15 – Andamento del volume
specifico dell’acqua al variare della temperatura
Ricordando la formula del Primo Principio della
Termodinamica
![]() (34)
(34)
Poichè, nel caso dei liquidi, v=cost si può
scrivere
![]() (35)
(35)
da cui
![]() (36)
(36)
Entalpia nei liquidi
Sarà ![]() (37)
(37)
In particolare si può dire che:
Nel
campo dei liquidi poiché v è costante si avrà ![]() indipendentemente dal cammino della trasformazione.
indipendentemente dal cammino della trasformazione.
Si noti quindi che ![]() (38)
(38)
Per
l’acqua ![]() (39)
(39)
Integrando l’equazione (35) si ottiene
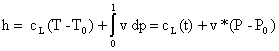 (40)
(40)
In generale, da un punto di vista numerico, si ha
![]() (41)
(41)
Ma non sempre il prodotto pressione-volume è
trascurabile.
Esempio:
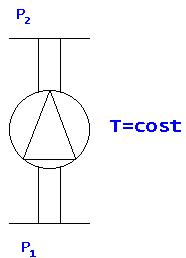
Fig. 16
Nello
schema di Figura 16 si ha una pompa che trasferisce liquido da una zona a
pressione P1 ad una zona con pressione P2. Questo processo avviene a
temperatura costante. Si ha quindi U2 = U1 ma h2> h1 per cui trascurando il
termine P*V si troverebbe che il lavoro della pompa non si conserva.
Entropia nei liquidi
Qualunque sia la trasformazione che subisce un
liquido si avrà sempre
![]() (42)
(42)
Per quanto riguarda l’entropia si avrà
![]() (43)
(43)
Integrando l’equazione (41) si ottiene
![]() (44)
(44)
Durante una trasformzaione di una sostanza allo stato liquido l’entropia
risulta proprorzionale al logaritmo del
rapporto tra la temperatura finale e quella iniziale.
Si
conclude che se la trasformazione avvenisse isotermicamente sarebbe anche isoentropica
Trasformazione Isotermica![]() Trasformazione Isoentropica
Trasformazione Isoentropica
Esercizi sui liquidi
Esercizio 1)
Sia data una vasca contenente acqua (Figura 17).
Un tubo disposto verticalmente attinga dalla stessa tramite una pompa avente una prevalenza Dp = 3 bar .
Questo salto di pressione venga misurato ai capi della pompa mediante un barometro differenziale.
Considerando che il tubo termini con un beccuccio da cui fuoriesce l’acqua, determinare in modo approssimativo la massima altezza Dzmax che può raggiungere lo zampillo rispetto al pelo libero della vasca.
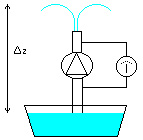
Fig. 17
Risoluzione
L’acqua ha una densità pari a rAcq = 1000 kg/m3 mentre per il mercurio rHg=13596 kg/m3 .
Per ottenere la stessa pressione che esercita una colonna di 760 mmHg (dall’esperienza di Torricelli), la colonna d’acqua dovrà avere un’altezza pari a:
![]() . (45)
. (45)
Da cui, se la prevalenza della pompa vale 3 BAR, l’acqua riuscirà a raggiungere una quota 3 volte superiore che in presenza della sola atmosfera (dato che PAtm = 1 BAR):
![]() . (46)
. (46)
Esercizio 2)
Si consideri un subacqueo zavorrato sul fondo del mare ad una profondità di 20m.
La sua capacità polmonare sia di V1 = 6l .
Dopo aver inspirato tale volume d’aria dalla bombola, egli risalga in superficie levando le zavorre che lo tengono ancorato.
Si assuma, inoltre, che la pressione dell’aria uscente dall’erogatore (P1) sia pari a quella dell’ambiente in cui si trova.
Determinare il volume (V2) dell’aria nei polmoni del sub risalito a galla e il valore della forza di galleggiamento dello stesso.
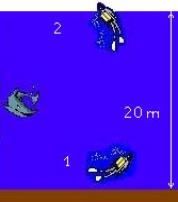
Fig. 18
Risoluzione
Conformiamo le unità di misura dei dati a quelle
del SI:
![]()
![]()
La pressione con cui l’aria esce dal respiratore è pari a quella presente nell’ambiente 1; essa è data dalla somma fra la pressione atmosferica e quella dovuta alla ipotetica colonna d’acqua di 20m .
Viste le considerazioni fatte nell’esercizio precedente (una colonna d’acqua alta 10.3m esercita una pressione di 1 BAR), la pressione dovuta all’acqua è circa di 2 BAR, perciò:
![]() (47)
(47)
Supponendo che la temperatura corporea rimanga costante, possiamo considerare i polmoni del sub come un sistema chiuso in cui avviene una trasformazione isotermica:
![]() (48)
(48)
![]() (49)
(49)
e il volume in 2 sarà:
![]() (50)
(50)
Dato che il peso specifico dell’acqua è rAcq = 1000 kg/m3 e dato che la forza di galleggiamento è pari al peso del liquido spostato (Archimede), si ha:
![]() (51)
(51)
Nota: Se la risalita del sub
fosse troppo veloce, l’eccessivo aumento del volume dei polmoni causerebbe seri
danni alla salute. (Attenzione alle acque con gli squali!!!)
Esercizio 3)
Sia data una pentola contenente 10 lb di acqua ( Figura 19).
Venga messa sul fuoco aumentando la temperatura dell’acqua prima da 0°R a 80°R e in un secondo esperimento da 32°F a 212°F.
Determinare la quantità di calore necessaria per operare il riscaldamento nei due casi.
Fig. 19
Risoluzione
Conformiamo le
unità di misura dei dati a quelle del sistema internazionale:
a)
0°R =
0°C
b)
80°R =
100°C
c)
32°F =
0°C
d)
212°F
= 100°C
e)
10lb
(GB) = 4356g
f)
1 cal
= 4,186 J
Quindi l’acqua subisce in ogni caso un salto di temperatura che và dal congelamento all’ebollizione (DT = 100°C).
La caloria è la quantità di calore necessaria per innalzare da 14.5°C a 15.5°C la temperatura di 1g d’acqua alla pressione atmosferica.
Perciò il calore necessario per la trasformazione è lo stesso in entrambi i casi e vale:
![]() (52)
(52)
![]() (53)
(53)
Vapori Saturi
Nel
diagramma termodinamico (P,V) lo stato di vapore saturo si trova nella regione
tratteggiata di Figura 20
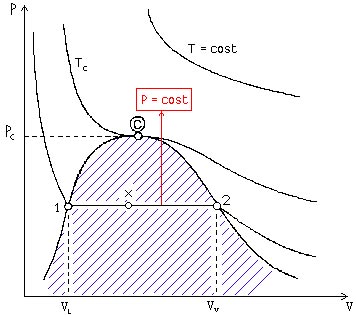
Fig. 20
Una
prima osservazione che si può fare dall’analisi del grafico è che per un vapore
saturo vale la relazione
P = cost (54)
Quando
si ha a che fare con vapori saturi non esiste un legame analitico semplice che
descriva pressione, volume e temperatura.
Quindi
la risoluzione di problemi in maniera analitica, in maniera chiusa, non è
possibile.
Servono delle tabelle
o dei grafici che riportino alcune proprietà dei vapori saturi in funzione di
altre.
Esempio:
|
Pressione [BAR] |
Temperatura [°C] |
|
0,006 |
0 |
|
1,013 |
100 |
|
4,85 |
150 |
|
15,86 |
200 |
|
40,5 |
250 |
|
87,61 |
300 |
|
190,4 |
360 |
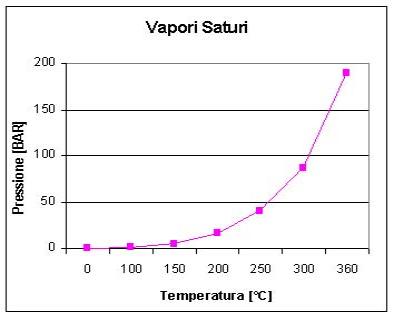
Si nota che l’andamento pressione-temperatura non
è affatto lineare.
Nella Figura 20 è indicato un punto “x” detto
TITOLO e definito come
![]() (55)
(55)
Il
vapore saturo al titolo x ha proprietà termodinamiche che sono la media pesata
delle proprietà di liquido e vapore.
Esempio:
![]() (56)
(56)
![]() (57)
(57)
![]() (58)
(58)
Dove
si è indicato con hD l’entalpia differenziale (talvolta indicata con
“r” in alcuni testi), con vD il volume differenziale e con SD
l’entropia differenziale.
Si
noti che ![]() perché r è il calore necessario
per passare da liquindo a gas e durante questo processo la temperatura T rimane
costante.
perché r è il calore necessario
per passare da liquindo a gas e durante questo processo la temperatura T rimane
costante.
Energia interna dei vapori saturi
Per definire l’energia interna dei vapori saturi si usa la definizione classica:
![]() (59)
(59)
L’energia interna al titolo x sarà
![]() (60)
(60)
In generale ![]() e
e ![]() in base alla
definizione di entalpia
in base alla
definizione di entalpia
Esempi
applicativi della risoluzione di esercizi con l’utilizzo di tabelle
Di un vapore saturo siano assegnati pressione e titolo:
P = 50 BAR
x = 0,7
Trovare la temperatura, l’entalpia,
l’entropia e il volume specifico di
tale vapore saturo.
Dalla
tabella si legge che per P=50 BAR e x = 0,7 il vapore saturo si trova ad una
temperatura T di 263 °C. Inoltre si ha:
![]()
![]()
![]()
Applicando le formule 56 - 57 – 58 si trova
![]() (61)
(61)
![]() (62)
(62)
![]() (63)
(63)
Si
noti l’enorme valore di entropia: questo è dovuto al fatto che il cambiamento
di fase (liquido-vapore) muove una grande quantità di calore latente.
La quantità SD la potevo anche
calcolare come rapporto ![]()
![]() (64)
(64)