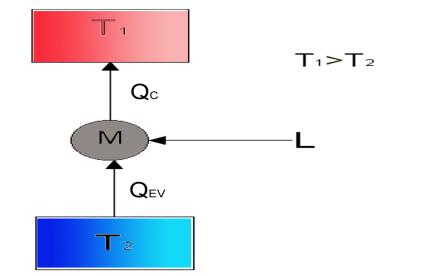
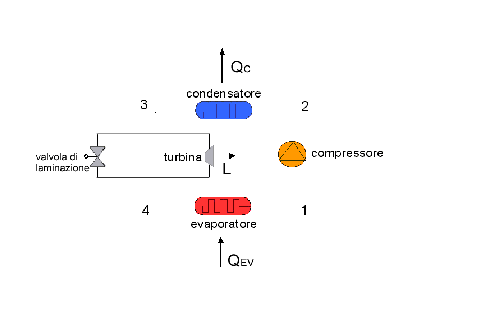
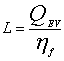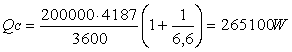In questo caso si ha :
-
il
condensatore in cui il vapore corre nel tubo a serpentina mentre all’ esterno
vi è l’aria fredda;
-
l’evaporatore
che ha funzione della caldaia nel ciclo Rankine;
-
il
compressore che compie una trasformazione adiabatica reversibile (isoentropica)
-
la
turbina oppure la valvola di laminazione (che dà luogo ad una trasformazione
irreversibile).
Il fluido utilizzato è nel 70% dei casi l’ammoniaca
e per il restante 30% il Freon (miscela di CloroFluoroCarburi). I pregi
dell’ammoniaca sono il costo irrisorio e le migliori proprietà termodinamiche
(il diagramma è noto) ma purtroppo è tossica. Il Freon è stato brevettato per
la prima volta dalla Dupont ; esistono un numero considerevole di queste
miscele ed ognuna ha un diagramma termodinamico diverso quindi la maggiore
fonte di informazioni in merito rimane il produttore. Il più noto è il Freon 12
(I generazione, il brevetto dura 20 anni) ma anch’esso è tossico in quanto
danneggia lo strato di ozono. Negli anni sono state sviluppate miscele di II e
III generazione.
Analizziamo il funzionamento
della macchina considerando il diagramma p-v
prendendo in considerazione le
due differenti ipotesi (la turbina oppure la valvola di laminazione) :
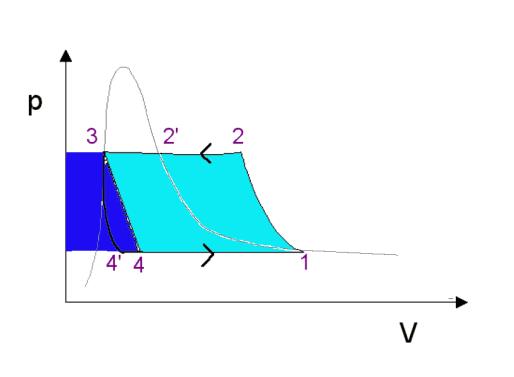
Fig. 3
La
serpentina del condensatore dev’essere il più libera possibile per cedere
facilmente calore. Viceversa sarà necessario un aumento di temperatura che
comporterà evidentemente un aumento di consumi. La differenza di temperatura
tra evaporatore e condensatore è dell’ordine di 30 – 35 °C a cui corrisponde
una variazione di pressione di 4 – 5 bar. Quindi per minimizzare il lavoro è
necessario diminuire il DT.
Con la
turbina si recupera una quota di lavoro ma questo organo è complesso e costoso
(anche se di piccole dimensioni). Questo non è possibile con la valvola che è
più economica ma noteremo più avanti che il lavoro recuperato sarebbe
praticamente trascurabile
Analizziamo per comodità il diagramma T-s
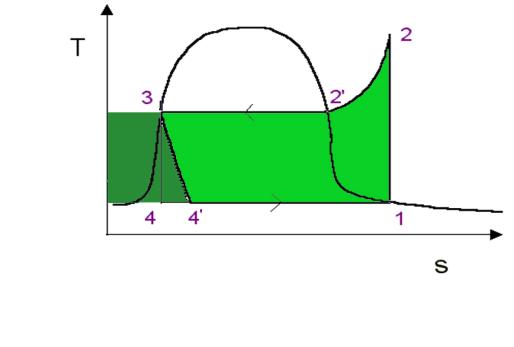
Fig. 4
L’area sottesa è priva di
significato essendo appunto il ciclo irreversibile.
La valvola è
collocata tra la serpentina del condensatore e la cella frigorifera, ha la
forma di un capillare in modo che il fluido perda pressione nello strozzamento:
se non si mantiene DP non si mantiene DT. Esiste un punto
ottimo di chiusura della valvola che produce la massima performance della
macchina.
Con il diagramma h-s
osserviamo che:
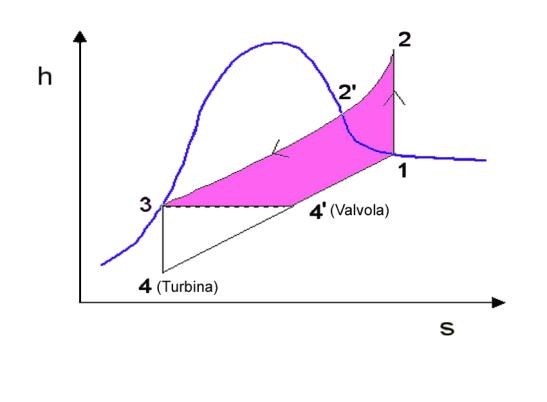
Fig. 5
con la valvola la
trasformazione è isoentalpica e irreversibile
perché Q=0, L=0 allora h3 = h4 mentre con la turbina è isoentropica e reversibile.
Il diagramma più usato è il p-h
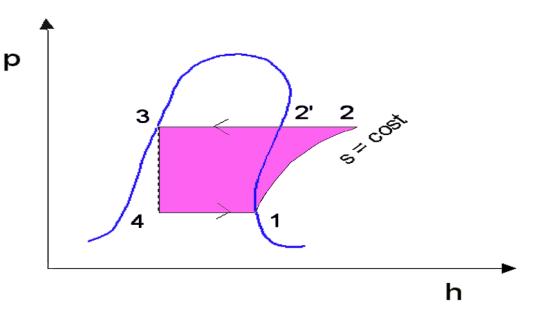
Fig. 6
Esso è
riferito al Freon 12. Non essendo disponibili tabelle la soluzione grafica è
l’unica fonte di informazioni nella risoluzione dei problemi pratici.
Per il
calcolo delle prestazioni termodinamiche della macchina si possono utilizzare
due grandezze distinte:
- l’effetto utile frigorifero
(se si vuole raffreddare il serbatoio a temperatura minore)
definito come
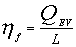
dove
QEV è
il calore assorbito e L il lavoro richiesto dal sistema.
Di solito il coefficiente hf vale 5 – 6.
- il coefficiente di
prestazione (se si usa la macchina come pompa di calore)
definito come
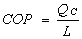
dove
QC è
il calore fornito e L il lavoro richiesto dal sistema.
Vale
inoltre la seguente relazione
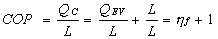
cioè si
dimostra che il funzionamento come pompa di calore è più conveniente rispetto a
quello come macchina frigorifera.
ESEMPIO.
MISCELE DI ARIA E VAPORE ACQUEO
L’aria sarà considerata come
un solo componente e la sua
composizione sarà assunta costante. La composizione di dettaglio in volume
dell’aria secca è:
78% Azoto
21% Ossigeno
1% Gas
rari (tra cui elio, neon, argon) e una piccolissima percentuale di Anidride
Carbonica. All’aria aperta la percentuale di CO2 è circa 0.03%,
quindi si può considerare quasi assente.
L’acqua potrà essere in parte
liquida ed in parete vapore.
La fase gassosa della miscela sarà
considerata una miscela di due gas ideali: aria e vapore acqueo infatti il
vapore presenta una pressione parziale molto piccola, quindi è lecito
trascurare il comportamento da vapore surriscaldato. La composizione
della fase gassosa potrà variare, per effetto di
evaporazione o condensazione di acqua.
Quindi la massa di aria
secca viene considerata costante (perché l’aria non si crea ne si distrugge a
parte casi rari) mentre la massa di vapore cambia facilmente. Questo fatto
spiega perché le grandezze specifiche non vengono riferite all’unità di massa
della miscela, ma all’unità di massa dell’aria secca (si mantiene questa
convenzione anche per compatibilità con il passato e per comodità). Ad esempio
si parla di entalpia specifica definita come:

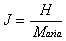 ove Maria =
massa dell’aria secca.
ove Maria =
massa dell’aria secca.
Saturazione
dell’aria e titolo
Consideriamo il seguente
esperimento: in presenza di aria inizialmente secca poniamo su una bilancia un
recipiente contenente acqua mantenendo pressione P e temperatura T
costanti.
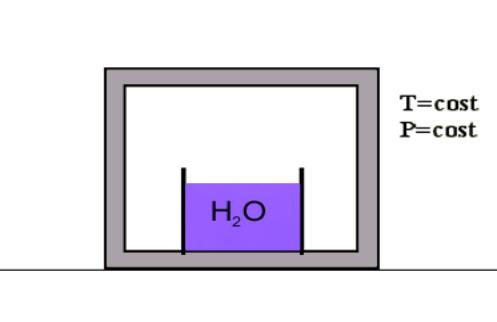
Fig. 7
Dopo un certo periodo di
tempo il livello di acqua nel contenitore sarà calato, cioè una certa massa di
H2O sarà evaporata nell’aria , e il livello continuerà a calare
sempre più lentamente fino a rimanere costante (quindi la bilancia misurerà una
diminuzione della massa di acqua)
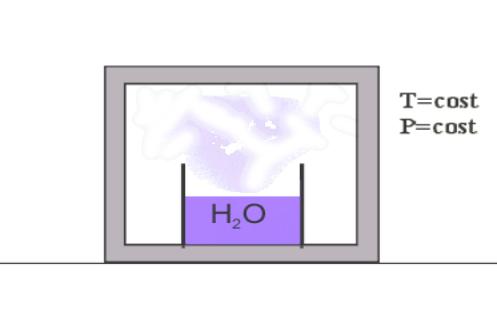
Fig. 8
Questa esperienza mostra che
se si mettono a contatto aria e acqua liquida , a temperatura e pressione
costanti , l’acqua evapora fino a che la pressione parziale del vapore saturo
eguaglia la pressione di saturazione dell’acqua alla temperatura T alla quale si opera.
In altri termini la presenza
d’acqua non influisce sulla quantità di acqua che si volatilizza , ma soltanto
sulla velocità del processo.
A questo punto possiamo introdurre una nuova
grandezza : il titolo, definito come
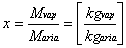 (
1 )
(
1 )
ove
Mvap
= massa di acqua evaporata
Maria= massa di aria secca
Kgvap = chilogrammi di vapore
Kgaria = chilogrammi di aria
Il titolo è il rapporto tra
pesi di sostanze chimiche diverse e non si tratta quindi di un numero puro. Non
va confuso con il titolo di vapore saturo che invece è un numero puro. Inoltre il
titolo x non è confinato ad essere
minore di 1 (ricordiamo che per il titolo di vapore saturo vale xvapore saturo < 1).
Di solito per evitare
semplificazioni dell’unità di misura, il titolo viene espresso in gvap /kg aria.
La grandezza che esprime
quale è la massima massa di acqua che può volatilizzarsi in una massa di aria
secca è il titolo di saturazione,
cioè il titolo calcolato in condizioni di equilibrio tra aria e acqua in
presenza di acqua liquida (in
riferimento all’esperimento visto, il titolo calcolato quando il livello dell’acqua resta costante).
Il titolo di saturazione xsat è
dipendente da temperatura e pressione
xsat =
xsat (p,t), ad esempio cresce al
crescere della temperatura, quindi quando si parla di titolo di saturazione si
considerano fissati i valori di questa due grandezze.
Solitamente si lavora in un sistema isobaro , a
pressione atmosferica patm=1,013
bar quindi la dipendenza viene ad essere dalla sola temperatura.
I valori del titolo di
saturazione riferiti alla pressione atmosferica in funzione della temperatura
sono reperibili su apposite tabelle.
Tabella 1
Tabella dei valori assunti da alcuni parametri
termodinamici della miscela aria-vapore acqueo per j = 1 e P = 1.013 bar
|
Temperatura
dell’aria
T
°C
|
Pressione di vapore dell’aria satura
P mbar P mmHg
|
Titolo di saturazione
x
g/Kg
|
|
-20
|
1.02
|
0.756
|
0.63
|
|
-19
|
1.13
|
0.848
|
0.7
|
|
-18
|
1.25
|
0.938
|
0.77
|
|
-17
|
1.37
|
1.028
|
0.85
|
|
-16
|
1.5
|
1.125
|
0.93
|
|
-15
|
1.65
|
1.238
|
1.01
|
|
-14
|
1.81
|
1.358
|
1.11
|
|
-13
|
1.98
|
1.485
|
1.22
|
|
-12
|
2.17
|
1.628
|
1.34
|
|
-11
|
2.37
|
1.778
|
1.46
|
|
-10
|
2.59
|
1.943
|
1.6
|
|
-9
|
2.83
|
2.123
|
1.75
|
|
-8
|
3.09
|
2.318
|
1.91
|
|
-7
|
3.36
|
2.520
|
2.08
|
|
-6
|
3.67
|
2.753
|
2.27
|
|
-5
|
4
|
3
|
2.49
|
|
-4
|
4.36
|
3.270
|
2.69
|
|
-3
|
4.75
|
3.563
|
2.94
|
|
-2
|
5.16
|
3.870
|
3.19
|
|
-1
|
5.61
|
4.208
|
3.47
|
|
0
|
6.09
|
4.568
|
3.78
|
|
1
|
6.56
|
4.920
|
4.07
|
|
2
|
7.04
|
5.280
|
4.37
|
|
3
|
7.57
|
5.678
|
4.7
|
|
4
|
8.11
|
6.083
|
5.03
|
|
5
|
8.7
|
6.526
|
5.4
|
|
6
|
9.32
|
6.991
|
5.79
|
|
7
|
9.99
|
7.493
|
6.21
|
|
8
|
10.7
|
8.026
|
6.65
|
|
9
|
11.46
|
8.596
|
7.13
|
|
10
|
12.25
|
9.188
|
7.63
|
|
11
|
13.09
|
9.818
|
8.15
|
|
12
|
13.99
|
10.493
|
8.75
|
|
13
|
14.94
|
11.206
|
9.35
|
|
14
|
15.95
|
11.963
|
9.97
|
|
15
|
17.01
|
12.759
|
10.6
|
|
16
|
18.13
|
13.599
|
11.4
|
|
17
|
19.32
|
14.491
|
12.2
|
|
18
|
20.59
|
15.444
|
12.9
|
|
19
|
21.92
|
16.441
|
13.8
|
|
20
|
23.31
|
17.484
|
14.7
|
|
21
|
24.8
|
18.602
|
15.6
|
|
22
|
26.37
|
19.779
|
16.6
|
|
23
|
28.02
|
21.017
|
17.7
|
|
24
|
29.77
|
22.3
|
18.8
|
|
25
|
31.6
|
23.702
|
20
|
|
26
|
33.53
|
25.150
|
21.4
|
|
27
|
35.56
|
26.672
|
22.6
|
|
28
|
37.71
|
28.285
|
24
|
|
29
|
39.95
|
29.965
|
25.6
|
|
30
|
42.32
|
31.748
|
27.2
|
|
31
|
44.82
|
33.618
|
28.8
|
|
32
|
47.46
|
35.575
|
30.6
|
|
33
|
50.18
|
37.638
|
32.5
|
|
34
|
53.07
|
39.806
|
34.4
|
|
35
|
56.1
|
42.078
|
36.6
|
|
36
|
59.26
|
44.449
|
38.8
|
|
37
|
62.6
|
46.954
|
41.1
|
|
38
|
66.09
|
49.572
|
43.5
|
|
39
|
69.75
|
51.317
|
46
|
|
40
|
73.58
|
55.198
|
48.8
|
|
41
|
77.59
|
58.197
|
51.7
|
|
42
|
81.8
|
61.355
|
54.8
|
|
43
|
86.18
|
64.64
|
58
|
|
44
|
90.79
|
68.098
|
61.3
|
|
45
|
95.6
|
71.706
|
65
|
|
46
|
100.61
|
75.464
|
68.9
|
|
47
|
105.87
|
79.409
|
72.8
|
|
48
|
111.33
|
83.504
|
77
|
|
49
|
117.07
|
87.81
|
81.5
|
|
50
|
123.04
|
92.288
|
86.2
|
|
55
|
150.94
|
117.715
|
114
|
|
60
|
198.7
|
149.037
|
152
|
|
65
|
249.38
|
187.05
|
204
|
|
70
|
310.82
|
233.134
|
276
|
|
75
|
384.5
|
288.398
|
382
|
|
80
|
472.28
|
354.239
|
545
|
|
85
|
576.69
|
432.553
|
828
|
|
90
|
699.31
|
524.525
|
1400
|
|
95
|
834.09
|
625.618
|
3120
|
|
100
|
1013
|
759.812
|
-
|
Il titolo di
saturazione non dipende dalla presenza dell’aria , ma esclusivamente dal vapore. Nell’esperimento precedentemente
visto la massa di acqua evaporata sarebbe stata la medesima anche in assenza di
aria (nel vuoto) in quanto , per ipotesi di gas perfetto, il vapore si espande
come se l’aria non ci fosse.
L’unica
differenza è data dalla velocità di vaporizzazione in quanto la presenza
dell’aria rallenta il raggiungimento dell’equilibrio.
Il concetto che sia l’aria a saturarsi è sbagliato
perchè in realtà è l’acqua che si satura.
Grado igrometrico
Il titolo x è un numero piccolo e preso a se stante non ci da una indicazione diretta
del livello di saturazione del vapore acqueo nella miscela : per capire se
l’aria sia secca o satura è necessario confrontare il titolo con quello di
saturazione . Quindi si rende opportuno introdurre una nuova grandezza: il grado
igrometrico , definito come :
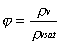 (
2 )
(
2 )
ove rv = massa del vapore acqueo
contenuto nell’unità di volume della fase
gassosa
rvsat= masa del vapore acqueo che sarebbe contenuto
nell’unità di volume della fase gassosa in condizioni di saturazione (cioè in
equilibrio con in liquido)
Poichè per un gas ideale , a temperatura fissata ,
la densità è proporzionale alla pressione
si ha anche , equivalentemente:
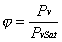 (
3 )
(
3 )
ove Pv
= pressione parziale di vapore acqueo nella miscela
Pv Sat = pressione di vapore
saturo secco
(fissata la temperatura T della miscela)
Il grado igrometrico può
assumere valori compresi tra 0 e 1 , oppure in modo equivalente può essere
espresso in percentuale ; in tal caso
prende il nome di umidità relativa .
Per capire meglio cosa sia
in pratica il grado igrometrico affidiamoci a questo esempio:
Consideriamo una massa
d’aria umida alla temperatura T = 20°C. La pressione di saturazione
ad una tale temperatura è Psat
= 23.31 mbar (questo valore è stato
ricavato dalla Tabella 1) e la pressione parziale del vapore contenuto nella
miscela è Pv = 16.317
mbar.
Il grado igrometrico si ricava dalla ( 3 ) sostituendo i valori numerici forniti:
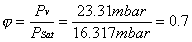 (o
equivalentemente Umidità relativa =
70%)
(o
equivalentemente Umidità relativa =
70%)
Questo significa che la
miscela contiene il 70% della quantità di vapore che la renderebbe satura.
Quindi il grado igrometrico j ci da una misura immediata
di quanto l’aria sia effettivamente prossima alla saturazione.
Ricaviamo allora la relazione tra titolo e grado
igrometrico
Consideriamo una miscela di
aria e vapore acqueo , in assenza di liquido. Noto il grado igrometrico j vogliamo
ricavare il titolo x relativo alla
miscela.
Per le ipotesi
precedentemente fatte , è lecito considerare aria e vapore acqueo0 come due gas
ideali. Quindi possiamo scrivere l’equazione di stato dei gas perfetti
separatamente per la massa d’aria e la
massa di vapore acqueo, considerando come volume a disposizione delle singole
massa il volume totale. (questa
assunzione discende dalla Legge di Dalton sulle miscele dei gas perfetti)
Quindi
Aria 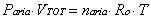 ( 4 )
( 4 )
Vapore acqueo 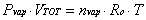 ( 5 )
( 5 )
Aria 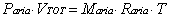 ( 8 )
( 8 )
Vapore acqueo 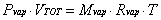 ( 9 )
( 9 )
Entalpia specifica
L’entalpia è una proprietà
estensiva. Pertanto ,l’entalpia specifica j
.cioè l’entalpia per chilogrammo di aria , sarà data dalla somma dell’entalpia
di 1 Kg di aria e l’entalpia di X Kg di aria , dove X è il titolo della miscela ovvero il
contenuto di vapore nell’aria.
Se siamo in assenza di acqua liquida
,sia l’aria sia l’acqua possono essere considerati gas ideali. Si adottano
usualmente le seguenti convenzioni:
Per l’aria:
nelle condizioni di gas ideale, alla temperatura T=0° C
entalpia specifica h= 0
Per l’acqua:
alla temperatura T=0 °C entalpia
specifica h=0 per il liquido sulla
curva limite inferiore. (Ricordiamo che in realtà la temperatura minima sulla
curva limite inferiore è quella del punto triplo , ma spesso si approssima la
temperatura del punto triplo dell’acqua con il valore 0 °C).
Con queste convenzioni si ha :
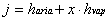 ( 20 )
( 20 )
Cerchiamo una espressione della ( 20 ) con i valori
numerici esplicitati.
Scriviamo l’equazione che
descrive l’entalpia del vapore acqueo nel punto C:
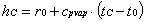 ( 21 )
( 21 )
Sapendo che :
1.
la
temperatura del punto A è quella del punto triplo TA=T0=
0 °C
2.
r0 » 2500 KJ/Kg dove r0 ,calore latente di vaporizzazione dell’acqua a 0 °C,
può essere ricavato dalle tabelle delle proprietà termodinamiche dell’acqua e del vapore saturo e corrisponde
alla variazione di entalpia tra i punti A
e B .
3.
il
calore specifico del vapore acqueo può essere assunto circa costante per
temperature basse come quella ambiente
: cpvap» 1,9
KJ/Kg.
Si ottiene:
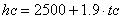 ( 22 )
( 22 )
dove tC
è al temperatura espressa in gradi Celsius.
Dalla espressione dell’entalpia per i gas perfetti
si ottiene:
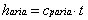 ( 23 )
( 23 )
ed essendo il calore specifico dell’aria cparia=1 KJ/Kg
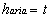 ( 24 )
( 24 )
Quindi sostituendo i valori ottenuti nella ( 20 ) si
ricava:

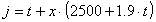 ( 25 )
( 25 )
Notiamo che la ( 25 ) è una
formula dimensionalmente non omogenea , una formulazione più corretta ( che ha
un significato fisico ) sarebbe :
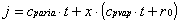 ( 26 )
( 26 )
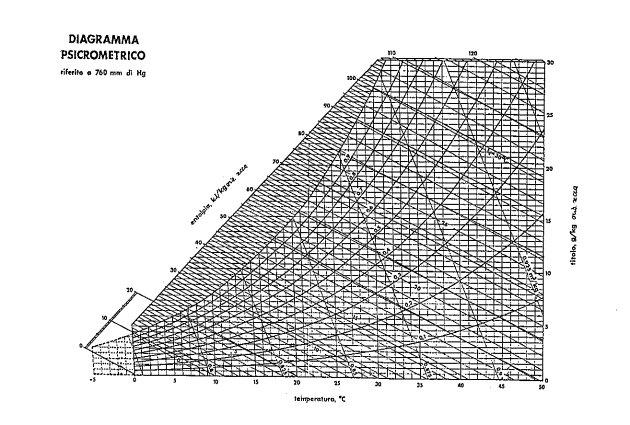
Diagramma Psicrometrico
Sul diagramma psicrometrico è possibile individuare gli stati di
equilibrio delle miscele d’aria e acqua (che possono interessare anche il
dimensionamento di condizionatori e impianti per il trattamento dell’aria).
Su tale diagramma sono
indicati tre assi:
1.
Asse
x, verticale, posto nel margine
destro, sul quale si possono leggere i valori del titolo della miscela in gvap/Kgaria;
2.
Asse
T, orizzontale, sul quale si possono
leggere le temperature espresse in °C.
3.
Asse
j posto diagonalmente nel margine sinistro, sul quale si possono
leggere i valori dell’entalpia specifica in kJ/Kgariasecca .
Forniamo un esempio di diagramma psicrometrico ad
una pressione pari a 1.013 Bar.