Università degli studi di Parma
Facoltà
di Ingegneria Elettronica
Corso di Fisica Tecnica
Prof.
Angelo Farina
Anno accademico 2000/2001
Lezione
del 23-10-2000-10-26 ore 16.30-18.30
Trascrizione
di Lucchini Matteo matr.123952
CICLO DI RANKINE
Una delle applicazioni più rilevanti della termodinamica in campo ingegneristico è lo studio e il perfezionamento di apparati per convertire il calore in lavoro il più efficacemente possibile. La soluzione ottimale è rappresentata dalle macchine di Carnot, che tuttavia non sono fisicamente realizzabili, dunque si opera sfruttando altri dispositivi meno efficienti, ma reali.
Una delle alternative più utilizzate è quella di impiegare
come intermediario un fluido, che può essere un gas od un vapore, che
attraverso una serie di trasformazioni termodinamiche compie dei cicli al
termine dei quali si ritrova nello stato fisico iniziale. In molte macchine di
utilizzo comune nelle centrali energetiche il fluido utilizzato è l’acqua che
viene alternativamente vaporizzata e condensata all’interno di macchine dette,
appunto, a vapore.
Il ciclo descritto prende il nome di ciclo Rankine e la macchina che lo compie
è schematizzabile in quattro
componenti:
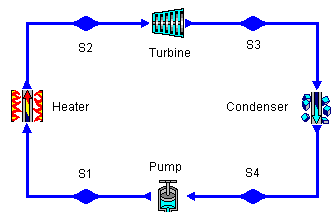
Essi
sono:
-
una caldaia (heater) che fa bollire l’acqua vaporizzandola
-
una turbina (turbine) che sfrutta
l’espansione del vapore per produrre lavoro
-
un condensatore (condenser) che rende nuovamente liquido il vapore
-
una pompa (pump) che chiude il ciclo
per
studiarne il funzionamento utilizziamo uno schema che identifichi i punti
principali delle trasformazioni :
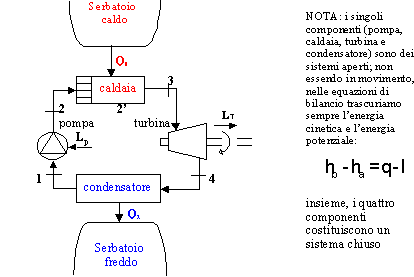
I diagrammi termodinamici più adatti ed usati per
studiarlo sono quello Pressione-Volume p-v, quello Entalpia-Entropia h-s o diagramma di
Mollier (particolarmente impiegato per il calcolo delle turbine a vapore)
e quello Temperature assolute-entropia T-s
(tra i tre il più usato)
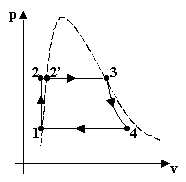
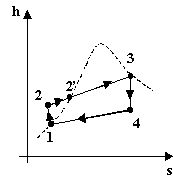
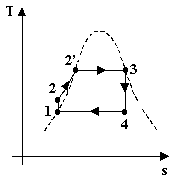
Esaminiamo ora il ciclo passo per passo:
1-2 L’acqua proveniente dal condensatore viene
compressa adiabaticamente (dunque ad entropia costante e nel grafico T-s
abbiamo una retta verticale). La temperatura durante questo passo varia
pochissimo (il segmento nel grafico temperatura-entropia è infatti breve) così
come il volume del liquido (è quasi incomprimibile come si vede nel grafico p-v
dove abbiamo una segmento quasi verticale). Dal 1° Principio della
termodinamica per i sistemi aperti (trascurando energia potenziale e cinetica
visto che l’intero sistema non è considerato in movimento) otteniamo il lavoro
compiuto dalla pompa:
![]()
Ora poiché in questa trasformazione il fluido è
nella fase liquida il calcolo delle entalpie risulta particolarmente agevole
ricordando che il volume rimane pressochè costante:
![]()
Con
v volume specifico dell’acqua e p1,p2 tabulate in funzione di T.
2-2’,2-3 Il liquido
viene prima riscaldato fino alla temperatura di vaporizzazione, poi portato
completamente allo stato di vapore secco (quindi a titolo unitario); viene
utilizzata una caldaia che preleva la quantità di calore Q1 da un serbatoio di
calore, di solito i fumi di una combustione. I processi avvengono entrambi
a pressione costante come si vede dal
diagramma p-v. Il sistema è di
tipo aperto che non scambia calore:
![]()
3-4 Il vapore entra in una turbina e si espande
adiabaticamente (dunque anche isoentropicamente) producendo movimento e quindi
lavoro meccanico sfruttabile ad esempio con un generatore. Notiamo che il
segmento rimane sotto la curva limite superiore (vedi oltre). Procediamo col
calcolo del lavoro prodotto:
![]()
Cerchiamo
di scrivere le entalpie in un modo equivalente per semplificare l’equazione.
Dunque possiamo usare:
![]()
![]()
![]()
Otteniamo
così una relazione dove la sola incognita è il titolo nel punto 4 che
determineremo più avanti
4-1 Il vapore a
bassa pressione viene immesso in un condensatore dove grazie ad una serpentina
fredda condensa completamente, a temperatura e pressione costante, recuperando
l’acqua del ciclo che può essere ripetuto senza perdite. Il liquido utilizzato
è infatti trattato e depurato per ottimizzarne il rendimento con un costo
conseguente che renderebbe svantaggioso non operare il riciclo e rinnovare il
fluido ad ogni ciclo. Il vapore saturo in questa trasformazione cede calore
alla serpentina fredda, dunque:
![]()
Ricordiamo
la convenzione dei segni che vuole positivi il calore assorbito e il lavoro
prodotto dal sistema e negativi il calore perduto e il lavoro ricevuto.
Per renderci conto dell’efficienza del ciclo di
Rankine calcoliamo il coefficiente
economico e, definito come rapporto tra
il lavoro prodotto e il calore scambiato:
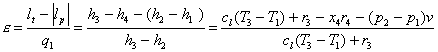
Procediamo ad un esempio numerico per quantificare i calcoli teorici e confrontare il coefficiente con quello ideale di un ciclo di Carnot che opera nelle stesse condizioni.
ESEMPIO NUMERICO
Utilizziamo
i seguenti dati:
T1=40°C
T2=250,3°C
P1=7,38
kPa
P2=4000
kPa
Calcoliamo
le entalpie:
h1
è tabulata
|
T (°C) |
p (BAR) |
h (kJ/kg) |
r (kJ/kg) |
s (kJ/kg) |
|
… |
… |
… |
… |
… |
|
32 |
0,047534 |
134,0 |
2425,9 |
0,4640 |
|
36 |
0,059400 |
150,7 |
2416,4 |
0,5184 |
|
40 |
0,073750 |
167,5 |
2406,9 |
0,5721 |
|
44 |
0,091001 |
184,2 |
2397,3 |
0,6252 |
|
48 |
0,11162 |
200,9 |
2387,7 |
0,6776 |
|
… |
… |
… |
… |
… |
![]()
![]()
Il
lavoro della pompa risulta dunque:
![]()
Per
il lavoro prodotto nella turbina ci servono h3 e h4:
![]()
Dove i valori di c e r sono tabulati in appositi grafici. Ad esempio:
|
p (bar) |
t (oC) |
hL(kJ/kg) |
r (kJ/kg) |
hv(kJ/kg) |
|
34 |
240,88 |
1041,3 |
1760,3 |
2802,1 |
|
36 |
244,16 |
1057,5 |
1744,2 |
2801,7 |
|
38 |
247,31 |
1072,7 |
1728,4 |
2801,1 |
|
40 |
250,33 |
1087,4 |
1712,9 |
2800,3 |
|
42 |
253,24 |
1101,5 |
1697,8 |
2799,4 |
|
44 |
256,05 |
1115,4 |
1682,9 |
2798,3 |
|
46 |
258,75 |
1128,8 |
1668,3 |
2797,0 |
|
48 |
261,37 |
1141,8 |
1653,9 |
2795,7 |
Quantitativamente osserviamo che il vapore ad alta temperatura e pressione produce molto lavoro.
Per
h4 il calcolo presenta una difficoltà:
![]()
Abbiamo già h1, r4 è uguale ad r1, ma non conosciamo il titolo x4; possiamo procedere in due modi:
-una soluzione grafica sfruttando i diagrammi
termodinamici per stimare il valore
-sfruttando
il fatto che la trasformazione 3-4 è isoentropica, come è facile notare dal
diagramma T-s.
Operiamo
per la seconda strada:
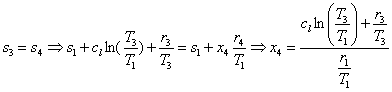
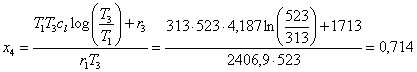
Usiamo
questo valore di x4 per calcolare h4 e il lavoro meccanico prodotto:
![]()
![]()
Abbiamo
ora tutti i dati per calcolare il coefficiente economico del ciclo di Rankine e
confrontarlo con quello di Carnot:
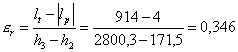
![]()
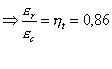
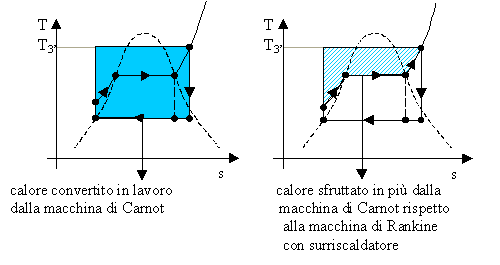
In conclusione anche se dal solo coefficiente economico del ciclo Rankine il risultato non sembra assolutamente soddisfacente, confrontandolo col ciclo ideale di Carnot si scopre che in realtà la conversione è molto buona. E’ possibile vederlo anche esaminando i diagrammi T-s dei due cicli:
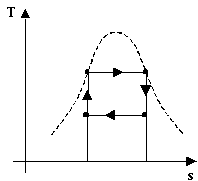
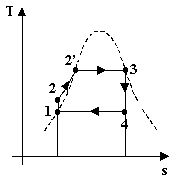
Il ciclo di Rankine presenta delle irreversibilità esterne, come ad esempio la diminuzione di calore dei fumi di combustione della caldaia, ma il fluido rimane sempre in equilibrio termodinamico per cui è lecito pensare che l’area del ciclo nel diagramma rappresenti il lavoro prodotto, come per il ciclo di Carnot. Dalle figure è dunque possibile intuire un rendimento h vicino ad uno: i coefficienti e, rapporto tra lavoro prodotto (l’area del ciclo) e calore assorbito (l’area del ciclo più la porzione di grafico tra il ciclo e l’asse delle ascisse) sono molto vicini.
Ci chiediamo ora se è possibile migliorare la
conversione del calore in lavoro.
La strategia è quella di aumentare la temperatura
operativa con conseguente aumento di energia dei vapori. Tuttavia movendosi in
questo senso rimanendo nella zona interna alle curve limite all’aumento di T si
ottiene un conseguente drastico aumento di pressione che inevitabilmente
distruggerebbe la macchina. Si opera dunque riscaldando ulteriormente i vapori
secchi in uscita alla caldaia portandoli allo stato di vapore surriscaldato. In
questo modo otteniamo un secondo miglioramento non trascurabile: la
trasformazione 3-4 rimane quasi completamente all’esterno delle curve limite,
quindi abbiamo diminuito la presenza di goccioline di liquido condensato nella
turbina, che potevano danneggiare fisicamente il meccanismo erodendolo. Questo
modo di procedere ha portato alla macchine di Rankine con surriscaldatore.
MACCHINA DI RANKINE CON SURRISCALDATORE
Vediamo
uno schema di funzionamento per la macchina con serpentino riscaldatore.
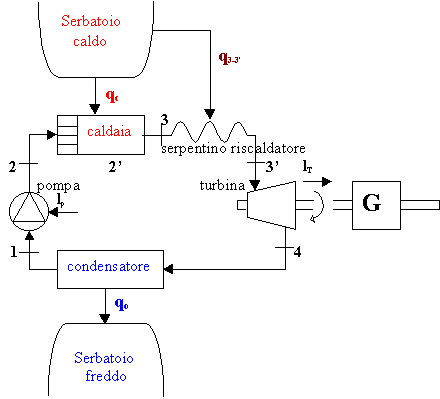
Vediamo
i diagrammi termodinamici del nuovo ciclo
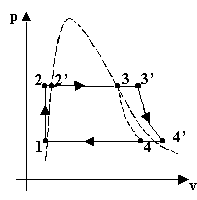
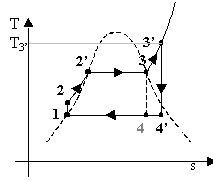
Possiamo renderci conto anche
graficamente del guadagno ottenuto, ad esempio nel diagramma T-s, dove viene
convertita in lavoro una porzione di grafico, rappresentante il calore,
superiore al calore che viene “rigettato” nel condensatore.
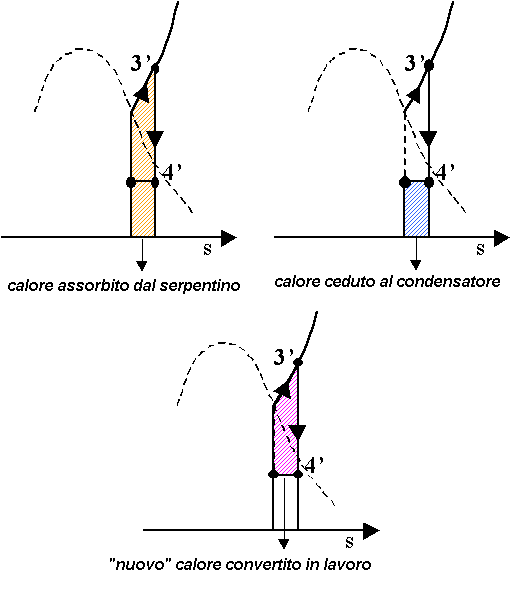
Ora nel calcolo termodinamico il titolo nello stato 4’ è
molto più vicino ad 1. La nuova formula per il coefficiente economico è:
![]()
Inoltre
per lo stato 3’ vale la formula:
![]()
![]()
in cui è possibile ricavare il calore specifico medio a pressione costante
leggendo l’entalpia in 3’ dalla tabella del vapore surriscaldato, o viceversa
ricavare h leggendo c dalla relativa tabella. Riportiamo un esempio di tabelle:
Tabelle
del vapore surriscaldato (p= 40 BAR)
(Tabelle
più complete sono reperibili su:
Zemanski “Termodinamica per ingegneri”)
|
T
(°C) |
h
(kJ/kg) |
s
(kJ/kg) |
|
250 |
2800,3 |
6,0685 |
|
300 |
2962,0 |
6,3642 |
|
350 |
3095,1 |
6,5870 |
|
400 |
3215,7 |
6,7733 |
|
450 |
3331,2 |
6,9388 |
|
500 |
3445,0 |
7,0909 |
|
550 |
3558,6 |
7,2333 |
|
600 |
3672,8 |
7,3680 |
|
650 |
3787,9 |
7,4961 |
|
700 |
3906,6 |
7,5947 |
|
T (°C) |
Cp (kJ/kg) |
|
300 |
3,136 |
|
350 |
2,891 |
|
400 |
2,742 |
|
450 |
2,648 |
|
500 |
2,579 |
|
550 |
2,533 |
|
600 |
2,500 |
|
650 |
2,472 |
|
700 |
2,458 |
Vediamo
un calcolo del coefficiente economico di un ciclo di Rankine con
surriscaldamento:
ESEMPIO NUMERICO
Usiamo gli stessi dati numerici dell’esercizio precedente:
T3=500°C
T3’=250,3
T1=40°C
Ripetiamo
i calcoli solo per i valori che hanno
subito variazioni:
![]()
Per
il titolo x4:
![]()
![]()
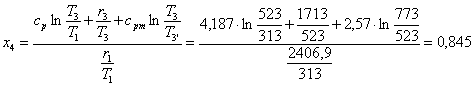
![]()
E
infine il coefficiente economico:
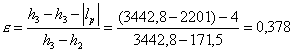
Il coefficiente è aumentato, anche se di poco perché
il riscaldamento introdotto era relativamente contenuto. Aumentando ancora il
calore dei vapori surriscaldati si può migliorare ancora il rendimento del
ciclo Rankine.
Notiamo che in questo caso sarebbe fuorviante
confrontare il coefficiente con quello del ciclo di Carnot calcolando h: in realtà si fornirebbe alla macchina di
Carnot una quantità di calore nettamente superiore a quella di Rankine con
surriscaldatore.
Infatti
se avessimo svolto i calcoli nell’ultimo esercizio con surriscaldatore avremmo
ottenuto:
![]()
Il rendimento apparentemente sembrerebbe peggiorato se
confrontato con il risultato di 0,86
ottenuto nel caso senza serpentina surriscaldante. In realtà questa
configurazione è molto più brillante della precedente da un punto di vista del
2° principio della Termodinamica dal momento che il calore dei fumi usati nella
caldaia per vaporizzare il liquido viene sfruttato molto più
efficacemente. Nonostante ciò in alcune
centrali energetiche invece di ottimizzare il rendimento del ciclo Rankine si
cercava di migliorare h lavorando con cicli a
temperature più basse che portavano a cicli meno performanti, ma più vicini ai
cicli ideali di Carnot.
Il ragionamento risulta ancora più intuitivo esaminando il diagramma che descrive l’andamento della temperatura dei fumi, prodotti bruciando combustibile e aria, in funzione della quantità di calore sottratta dalla macchina, confrontando così la quantità di calore effettivamente impiegata:
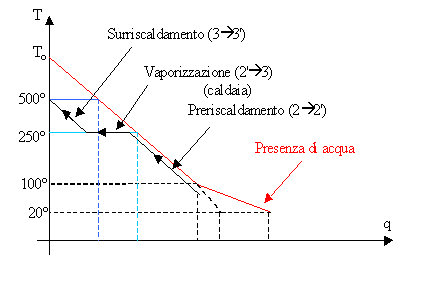
In rosso è rappresentato il diagramma T-q del
serbatoio caldo, in nero la trasformazione 2-3 del ciclo di Rankine con
surriscaldamento ed in blu e celeste due esempi di passaggi analoghi nel ciclo
di Carnot.
Si può notare che variando la temperatura dei fumi
(perdite di calore che producono un’irreversibilità di tipo esterno) l’unico
modo per sfruttare tutto il loro potenziale di calore è una successione infinita di cicli di Carnot, uno per ogni
variazione infinitesima di temperatura, dunque un processo irrealizzabile
fisicamente.
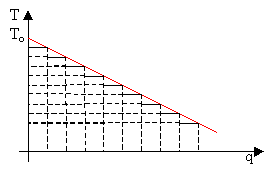
La macchina di Carnot funzionerebbe al meglio solo
se il serbatoio mantenesse costante la sua temperatura.