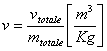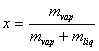SISTEMI
CHIMICAMENTE OMOGENEI
Argomenti trattati
Introduzione
Legge di Gibbs
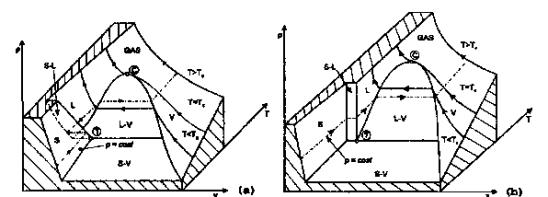
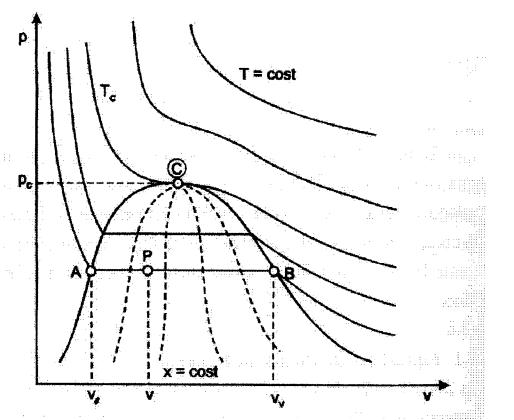
Superficie (p,v,T)
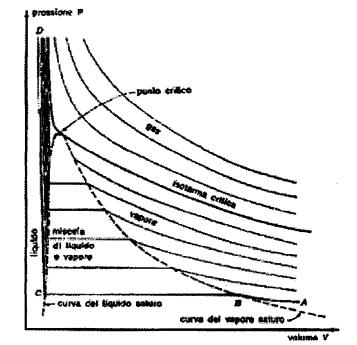
Diagramma termodinamico (p,v)
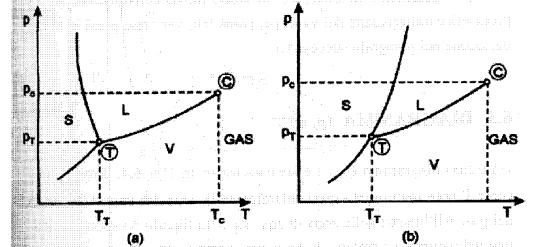
Diagramma (p,T)
Introduzione
In chimica e in fisica
s’intende per sistema la porzione più o meno grande di materia presa in esame
e che si comporta come un’unità per quanto attiene al fenomeno considerato.
Ogni sistema chimico-fisico è distinto da un altro che lo circonda e che si può
chiamare ambiente. In base ai rapporti che i sistemi stabiliscono con
l’ambiente circostante possono essere classificati in:
-
aperto : scambia con l’ambiente circostante sia energia
(sotto forma di calore e lavoro) sia materia. Un buon esempio può essere
rappresentato da una pentola senza coperchio posta su di un fornello.
-
chiuso : scambia con l’ambiente che lo circonda solo
energia ma non materia, la massa al suo interno si conserva costante.
S’immagini una pentola chiusa con un coperchio ermeticamente e posta su un
fornello. In questo caso avremo uno scambio di energia ma la quantità di
materia in essa contenuta rimarrà invariata.
-
isolato : non scambia né materia né energia con
l’ambiente. Questo terzo tipo di sistema è difficilmente realizzabile. La
pentola degli esempi precedenti per costituire un sistema di questo tipo
dovrebbe essere realizzata in modo tale che posta sul fuoco non dovrebbe
neppure scaldarsi.
Ci occuperemo di un
sistema chiuso costituito da una sostanza pura, sostanza che ha una
composizione chimica costante e in quanto tale buon esempio per un sistema
chimicamente omogeneo. Un sistema chimicamente omogeneo può essere
costituito da un liquido, come acqua o alcool, o da una sostanza allo stato
aeriforme, come ossigeno o azoto. In alcuni casi questi sistemi possono essere
formati anche da miscele come l’aria (entro una certa approssimazione può
essere considerata omogenea perché le proprietà dei gas che la compongono sono
abbastanza simili). Il sistema chimicamente omogeneo più studiato e che si è
analizzato è quello che utilizza l’acqua come sostanza pura. Ci si serve di
questa sostanza per l’abbondanza con cui si trova in natura, per il suo basso
costo e per alcune sue caratteristiche. Ha un elevato calore specifico e a
temperatura ambiente si trova allo stato liquido.
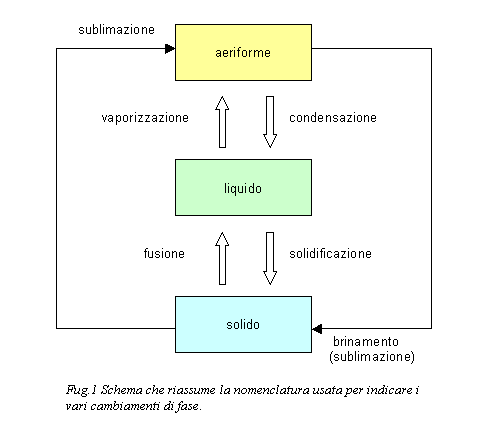
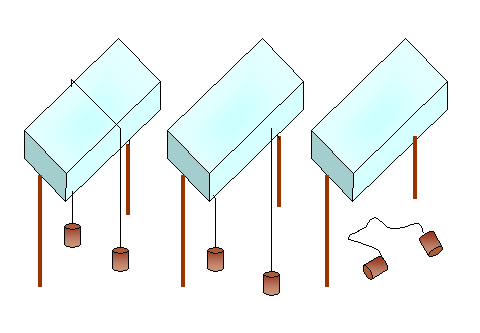
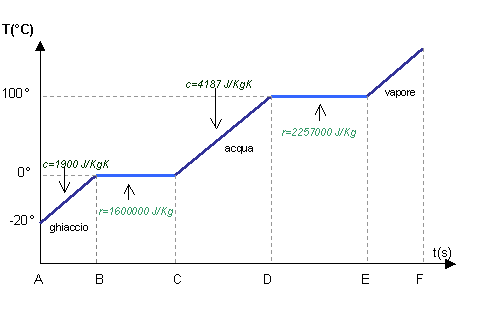
L’acqua, così come le
altre sostanze, può presentarsi in natura in tre differenti stati di
aggregazione. In particolare avremo:
- solido Þ ghiaccio
- liquido Þ acqua
- aeriforme
Þ vapore d’acqua o gas
d’acqua
I passaggi da uno stato
di aggregazione all’altro avvengono in modo graduale e sono contraddistinti da
nomi differenti (Fig.1).