
La materia, in natura, può assumere tre diversi stati di aggregazione che hanno proprie caratteristiche: stato solido, stato liquido, stato gassoso. Quest’ultimo è quello che ci interessa particolarmente in questa lezione per i suoi comportamenti al variare della temperatura e della pressione.
Per poter parlare dei gas e del loro comportamento bisogna però introdurre il concetto di gas perfetto. Innanzitutto bisogna chiarire che quello che andiamo ad introdurre è semplicemente un modello introdotto per semplicità di calcolo e di osservazione: non esiste infatti in Natura un gas che si comporti rispettando esattamente le leggi fisiche. Se ci spostiamo però su temperature elevate e pressioni basse ci si può rifare al modello dei gas ideali, che sono composti da atomi molto elementari che praticamente non interagiscono tra di loro e sono estremamente rarefatti (sono in un numero piccolo).

FIGURA 1: gli atomi dei gas perfetti non hanno interazioni tra loro, sono rarefatti ed elementari.
Gli atomi sono i più piccoli costituenti della materia; essi sono composti da tre tipi di elementi: i protoni, con carica positiva (indicati con p+) ed i neutroni, che non hanno carica (indicati con n) che ne vanno a costituire il nucleo (sono chiamati appunto “nucleoni”) e gli elettroni, con carica negativa (indicati con eˉ ) che si muovono su orbitali intorno al nucleo costituendo una sorta di “guscio” (a causa della loro elevata velocità di rotazione).
L’immagine dell’atomo è assimilabile a quella di un pianeta attorno al quale dei satelliti descrivono orbite diverse; gli ordini di grandezze sono però molto diversi, poiché per dare un’idea, il nucleo può essere paragonato ad una pallina da tennis, mentre gli orbitali ad un campo da calcio!
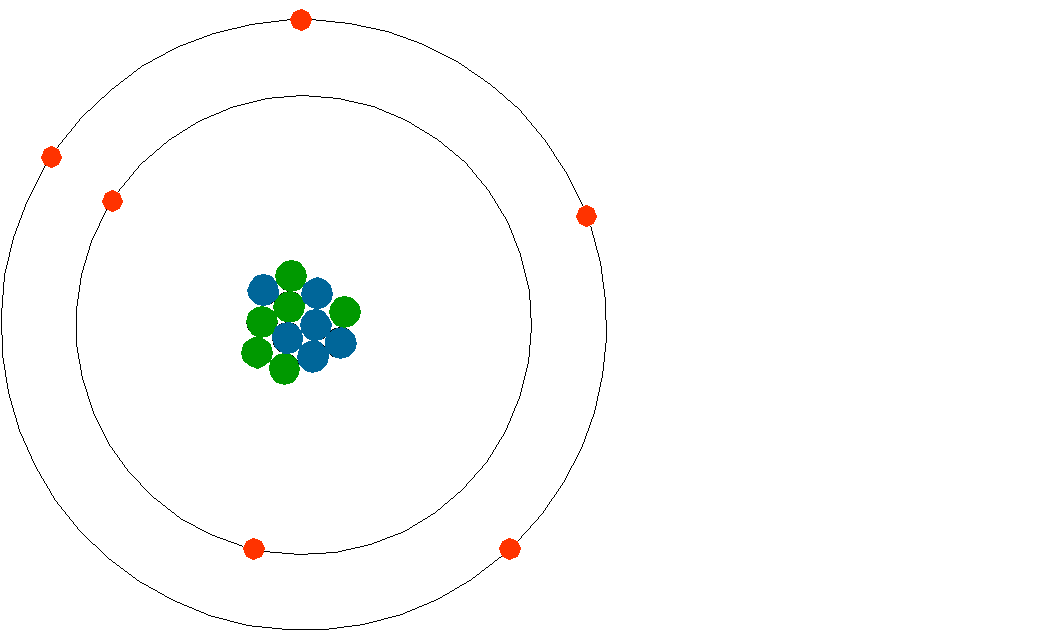
FIGURA 2: schematizzazione di un atomo di carbonio (C): in verde sono rappresentati i protoni, in azzurro i neutroni e in rosso gli elettroni. Gli orbitali vanno però pensati come gusci tridimensionali molto più vasti del nucleo.
Di seguito sono indicati le masse dei componenti dell’atomo:
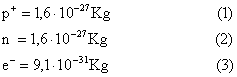
Nelle “tavole periodiche” sono riportati gli elementi, novantacinque esistenti in natura e cinque creati in laboratorio, con il loro numero di protoni.
I diversi elementi, mediante legami di ordine atomico, vanno a costituire le molecole, vere parti caratterizzanti della materia.
Se per esempio prendo un recipiente d’acqua e lo divido un numero considerevole di volte, scoprirò che l’acqua è costituita da due atomi di idrogeno (indicato con H) e di ossigeno (indicato con O) legati tra loro (come mostrato in figura).
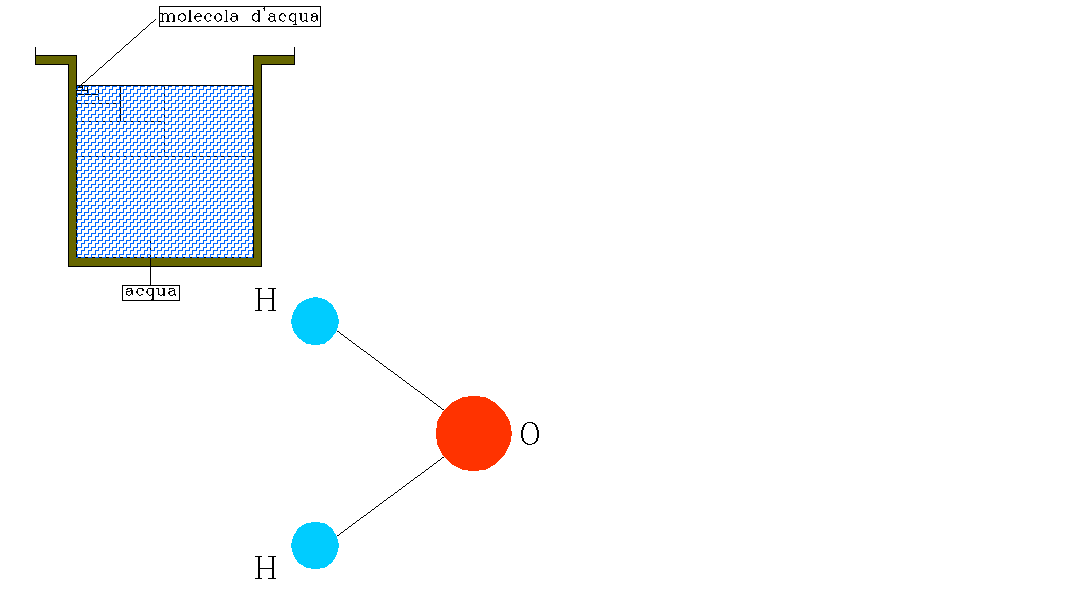
FIGURA 3: legame tra i due atomi di idrogeno e quello di ossigeno.
I gas differiscono rispetto alle sostanze liquide o solide proprio per il legame tra le molecole: in essi infatti è come se le sostanze fossero “biglie” staccate che rimbalzano in tutto lo spazio che le contiene; nel gas ideale sono completamente slegate, mentre in quello reale hanno interazioni.
LE REAZIONI CHIMICHE
Le reazioni chimiche avvengono tra molecole differenti e costituiscono nuovi legami distruggendo quelli vecchi.
Vi sono due tipi di reazioni:
1) reazioni esotermiche: avvengono con liberazione di calore; 2) reazioni endotermihe: avvengono con assorbimento di calore.
Un esempio di reazione è quella della pila a combustione che fornisce energia elettrica e non calore. Come mostra la figura 4, vengono inseriti in una soluzione di KOH ossigeno ed idrogeno che, reagendo tra loro, producono energia elettrica. Quando infatti la lampadina si illumina significa che sta avvenendo la reazione.
FIGURA 4: schema di una pila a combustione. Mediante la reazione è prodotta energia elettrica, come mostra l’accendersi della lampadina.
All’anodo (polo negativo) avviene la reazione:
![]()
Al catodo (polo positivo) avviene la reazione:
![]()
I prodotti di queste reazioni (acqua ed energia elettrica)
si possono riassumere nel seguente modo:
![]()
Se però considero la reazione contraria ho la cosiddetta cella elettrolitica che dall’immissione di energia elettrica in una soluzione acquosa fornisce idrogeno separando i legami dell’acqua. Lo schema di una cella elettrolitica è quello riportato nella figura 5.
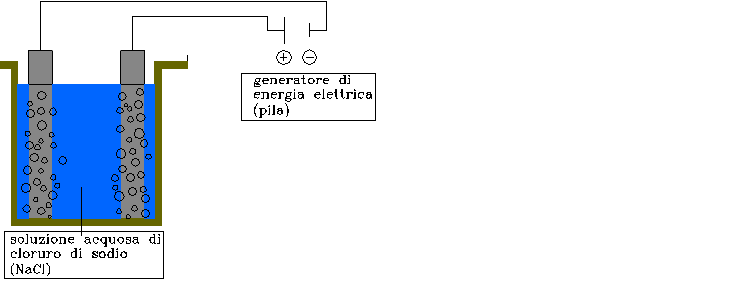
FIGURA 5: schema di una cella elettrolitica. Si può notare che agli elettrodi sono prodotte bolle dovute alla formazione di ossigeno sull’elettrodo positivo, e di idrogeno su quello negativo.
All’anodo avviene la reazione:
![]()
Al catodo avviene la reazione:
![]()
Si può parlare quindi di una reazione che può avvenire in entrambi i sensi: nel primo si produce acqua ed energia elettrica, nel secondo idrogeno.
IL CONCETTO DI MOLE
In generale una mole (indicata con mol) di qualunque sostanza ha una massa in grammi uguale al numero espresso dal peso atomico o dal peso molecolare della sostanza stessa. Una mole di un elemento è costituita da 6,02 × 10²³ molecole. Questo numero immenso è il numero di Avogadro.
Inoltre il peso atomico (u, da non confondersi con l’energia interna di un sistema!) di un elemento, che equivale al suo numero di nucleoni indicato sulla tavola degli elementi, è il suo peso effettivo se espresso in grammi.
Ad esempio per l’ossigeno il peso atomico (PA) è:
![]()
Il peso molecolare è di conseguenza la somma dei pesi dei
singoli atomi. Per l’acqua si avrà quindi:
![]()
Per chiarire maggiormente il concetto di mole: una mole di
acqua corrisponde al suo peso molecolare (ricordando che è la somma dei pesi
atomici) espresso in grammi. Quindi in diciotto grammi d’acqua trovo 6,02 ×
10²³ molecole d’acqua.
Una mole d’ossigeno peserà invece trentadue grammi.
RELAZIONE FONDAMENTALE
Una relazione fondamentale che ci permette di studiare il comportamento dei gas è:
p·v = R·T (11)
| dove | p è la pressione assoluta espressa in Pascal
(Pa); v è il volume specifico espresso in m³/Kg; Tè la temperatura espressa in k; R è una costante specifica del gas. |
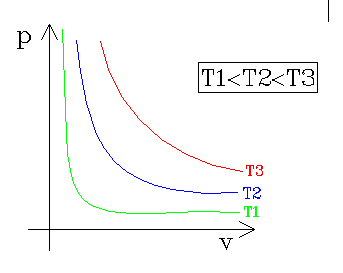
FIGURA 6: grafico dei gas ideali: mostra l’andamento delle isoterme (che sono delle iperboli) al variare della pressione e del volume.
Mediante Avogadro e il concetto di mole posso ricavare il numero n di moli:
![]()
| dove | n è il numero di moli M è la massa complessiva espressa in grammi m è la massa molecolare espressa in g/mol |
Procedendo nell’equazione precedente, se si moltiplicano entrambi i membri per m avrò
![]()
dove v·m è il volume specifico molare, cioè occupato da una mole ed R·m è la costante universale dei gas
![]() .
.
Ottengo così l’equazione
![]()
Se poi moltiplico entrambi i membri per n (numero di moli)
![]()
ottengo il volume totale delle moli, che si indica con V
![]()
Questa relazione vale sempre, per tutti i gas.
Si può anche ricavare R dalla formula inversa:
![]()
e trovarne i rispettivi valori.
Qui ne sono riportati alcuni a titolo di esempio:
|
Elemento |
Massa molecolare (g/mol) |
Valore di R (j/Kg·k) |
|
|
32 |
260,83 |
|
|
2 |
4126,4 |
|
|
28 |
296,91 |
In questo modo si può anche analizzare l’aria (considerandola un gas perfetto) la cui molecola si può immaginare composta da un 75% di azoto e da un 25% di ossigeno. Si avrà allora (considerando i valori della tabella):
![]()
TRE LEGGI IMPORTANTI
1. LEGGE
DI BOYLE
La pressione e il volume di una determinata quantità di gas,
ad una data temperatura, sono grandezze inversamente proporzionali:
p·V = costante (20)
2. PRIMA
LEGGE DI GAY-LUSSAC
Il volume di una certa massa gassosa, mantenuta a pressione
costante, aumenta all’aumentare della temperatura. La formula è:
![]()
3. SECONDA
LEGGE DI GAY-LUSSAC
La pressione di una certa massa gassosa, mantenuta a volume
costante, aumenta all’aumentare della temperatura. La formula è
![]()
In entrambi i casi α = 1/273,15 °C.
Le variazioni, sia per il volume che per la temperatura, sono lineari e rappresentabili con rette, come mostra la figura 7.

FIGURA 7: il primo è il grafico delle isobare (pressione costante), mentre il secondo è quello delle isocore (volume costante). Si noti che le pendenze delle rette sono tanto maggiori quanto più piccoli sono i valori di P e di V, che sono in funzione della temperatura.
CALCOLO DI ALCUNE GRANDEZZE
Per i gas perfetti l’energia interna (u) e l’entalpia (h) sono in funzione della temperatura. Le loro variazioni si calcolano:
![]()
Il calore specifico a volume costante è dato dalla formula:
![]()
Mentre il calore specifico a pressione costante è:
![]()
Il calore specifico a volume costante è espresso anche dalla relazione
![]()
con Q che è la quantità di calore misurata in j e m è la massa del gas.

FIGURA 8: la trasformazione precedente va considerata a volume costante.
Il calore specifico a pressione costante si può esprimere
![]()
con le medesime grandezze fisiche della precedente.

FIGURA 9:la trasformazione precedente va considerata a pressione costante.
Mediante le formule inverse si possono ricavare Δu e Δh:
![]()
ed anche:
![]()
dove ΔT è la differenza tra la temperatura iniziale e quella finale
Si può anche ricavare R caratteristica del gas:
![]()
Nella seguente tabella sono riportati alcuni valori notevoli dei due calori specifici:
|
Sostanza |
|
|
|
Acqua |
0,44 |
Mancante perché non è un gas |
|
Aria |
1,01 |
0,717 |
|
Idrogeno |
14,2 |
10,0 |
|
Ossigeno |
0,917 |
0,656 |
La differenza di entropia si calcola invece:
![]()
a pressione costante l’entropia è:
![]()
a volume costante l’entropia è:
![]()
TRASORMAZIONI ADIABATICHE
Consideriamo infine le trasformazioni adiabatiche, in cui non avviene nessun scambio di calore con l’ambiente circostante. Per un gas perfetto le trasformazioni adiabatiche seguono la legge di Poisson, espressa dalla formula:
![]()
dove p e v indicano la pressione e il volume
del gas ad un determinato istante e γ il rapporto tra i calori specifici
del gas a pressione e a volume costante. Il gas subendo un’espansione adiabatica,
si raffredda; al contrario, se viene compresso, si riscalda (un esempio si ha
quando si usa una pompa da bicicletta).
Questo avviene perché il gas, espandendosi, compie lavoro,
a spese della sua energia interna; poiché la sua energia interna è direttamente
proporzionale alla temperatura, espandendosi si otterrà una diminuzione della
temperatura. Il contrario avviene in una compressione.
Una trasformazione adiabatica, inoltre, avviene in modo irreversibile
e se ΔQ = 0, allora anche ΔS = 0 e si hanno curve in
cui l’entropia rimane costante.
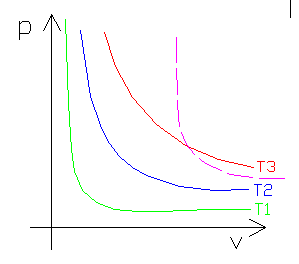
FIGURA 10: grafico delle isoterme con rappresentata una curva adiabatica (color Magenta tratteggiata); si noti che è più “ripida” all’inizio e meno verso la fine.