PROBLEMI
DI TERMODINAMICA
Vi
è una prima distinzione da fare nell’affrontare un problema di termodinamica:
1)
se esso riguarda il
vapore di acqua saturo
2)
se invece coinvolge miscele di aria e vapore.
Grandezza fondamentale in
entrambe i casi risulta essere il titolo X che si ottiene però in maniera
diversa, in quanto per
1) ![]() X =
X = ![]()
dove
Mv rappresenta la massa del vapore, mentre Mtot è la
massa totale. Quindi per esempio
Mv
= 0.05 Kg
Mliq
= 0.95 Kg
Mtot
= 1 Kg
X = ![]()
Diversamente si ha per
2)
X = ![]()
in
cui Ma è la massa secca dell’aria e non quella totale. Dunque in
questo caso
Mv = 5 kg
Ma = 100 kg
Mtot = 105 kg
X = ![]()
Possiamo notare come in questo secondo caso non via sia demarcazione netta
degli elementi coinvolti come avveniva nell’iterazione tra liquido e vapore, ma
vi è una miscela di aria e vapore. Proprio per questo motivo l’unità di misura
del TITOLO X va qui lasciata indicata, non essendo semplificabile una massa di
aria con una massa di vapore.
Poiché
i dati degli esercizi variano a seconda del numero di matricola dello studente,
di seguito verrà considerato per la risoluzione il numero di matricola 123456.
Per avere i risultati utilizzando dati di ingresso differenti, si rimanda alla
relativa tabella di Excel.
ESERCIZI
DAL COMPITO DEL 1/02/2001 (PRIMO APPELLO)
1°
Esercizio – Termodinamica
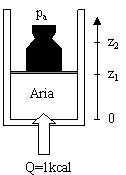
Aria secca è contenuta entro uno stantuffo, su cui grava la pressione
atmosferica ed un peso avente massa M pari a 100+AB kg, che mantiene costante
la pressione al suo interno. L’area dello stantuffo A è pari a 100+CD cm2. La
temperatura iniziale T1 del fluido entro lo stantuffo è pari 20+EF °C.
L’altezza iniziale dello stantuffo, z1, è pari a 100mm. Al fluido viene
comunicata dall’esterno una quantità di calore Q pari ad 1 kcal. Il fluido si
espande, sollevando il peso. Trovare:
- Altezza finale dello
stantuffo z2
- Temperatura finale T2
M = 112 kg
A = 134 cm2 = 0,0134 m2
T1 = 76 °C
z1 = 100 mm
Q = 1 kcal
Pa (pressione atmosferica) = 101.325 pa
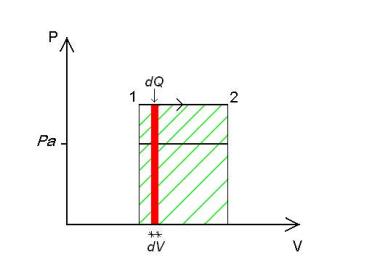
Il
fatto fondamentale da considerare è, innanzitutto, che la trasformazione
avviene a pressione costante, si ha cioè questa situazione
GRAFICO 1
Ptot = Pa +![]()
![]()
V1 =![]() =
= ![]()
Utilizzando
l’equazione di stato dei gas perfetti si ottiene inoltre:
P1V1 = 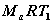
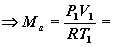
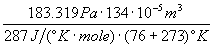 = 0,002455
kg
= 0,002455
kg
dove
si ricorda che P1, V1, T1, rappresentano
rispettivamente pressione, volume e temperatura allo stato iniziale, mentre R è
una costante.
Dal
primo principio della termodinamica sappiamo che
U2 – U1 = Q – L (1)
cioè
che la variazione di energia interna del sistema ![]() è pari al lavoro L
sottratto alla quantità di calore Q e inoltre dalla definizione
di ENTALPIA che
è pari al lavoro L
sottratto alla quantità di calore Q e inoltre dalla definizione
di ENTALPIA che
![]() (2)
(2)
Ma poiché il sistema passa dallo stato iniziale 1
a quello finale 2 tramite una trasformazione isobara (cioè a pressione
costante) dalla (2) segue che
![]()
e
da (1) si ottiene
![]() (3)
(3)
dove
cp è la capacità termica a pressione costante. Possiamo ora ricavare
T2 ricordando che 1kcal corrisponde a
4187 J:
![]()
![]() = 1781.4 °C
= 1781.4 °C
e
V2:
![]()
![]()
da cui otteniamo
l’altezza finale dello stantuffo
z2 =![]()
![]()
Vogliamo
ora calcolare aggiuntivamente
a) il lavoro L compiuto per sollevare il grave
b) la variazione di entropia ![]() .
.
Per quanto riguarda il primo punto si ha già disponibile
ogni dato:
![]() 0,589 m – 0,1 m = 0,489 m
0,589 m – 0,1 m = 0,489 m
L =![]()
![]()
A questo punto, una verifica del lavoro L così ottenuto
si può ottenere calcolando l’area del rettangolo sotteso al grafico della
trasformazione (GRAFICO 1)
L
= (V2 -V1) (P – Pa)
=(0,007896 m3 – 0,00134 m3) (183319 pa – 101325
pa) = 537 J
Per ricavare la variazione di entropia ricordiamo invece
la (3) e scriviamola sotto la forma
![]()
![]() =
=![]()
2°
Esercizio – Termodinamica
Risolvere nuovamente l’esercizio n. 1, ma
sostituendo vapore di acqua saturo all’aria secca. In questo caso non è
assegnata la temperatura iniziale T1, ma è invece assegnato il titolo x1, che
vale 0.1+F/40. Trovare:
- Altezza finale dello stantuffo z2
- Titolo finale x2
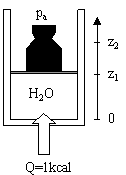
x1= ![]()
M = 112 kg
A = 134 cm2 = 0,0134 m2
T1 = 76 °C
z1 = 100 mm
Q =
1 kcal
Pa (pressione atmosferica) = 101325 pa
Consideriamo inizialmente che, trattandosi di vapore
di acqua saturo, il fatto di avere pressione costante ci permette di conoscere,
tramite le tabelle, anche la relativa temperatura di saturazione; abbiamo
infatti
P= 183319 pa ![]() Tsat=
117 °C
Tsat=
117 °C
siamo cioè di fronte
ad una trasformazione sia ISOBARA che ISOTERMA. Se ricordiamo ora la (3),
sappiamo che
H2 – H1
= Q = 4187 J
e che per calcolare
l’entalpia specifica possiamo considerare la relazione
hx = hL
+ xhd
in cui hL
e hd rappresentano rispettivamente l’entalpia specifica
dell’aria secca e l’entalpia specifica del vapore d’acqua e x il titolo.
Si ottiene quindi
che
![]() 4187 J (4)
4187 J (4)
Poiché in questo caso non vi è aria secca, hL2
e hL1 sono nulli; inoltre è dato il titolo x1, mentre
rimangono incognite l’entalpia hd che possiamo conoscere
attraverso le tabelle e pari a 2211 ![]() e MH2O che
si può ricavare dalla formula per il calcolo del volume specifico:
e MH2O che
si può ricavare dalla formula per il calcolo del volume specifico:
![]() (5)
(5)
Ma v1 si ottiene anche dalla relazione che lo lega al titolo x1; tramite
le tabelle si ha così che
(6) ![]() = 0,001058
= 0,001058 ![]() + 0,25
+ 0,25![]()
e sostituendo questo valore in (5) dove V1 era
già stato calcolato nel primo esercizio si ottiene
MH2O= ![]() = 0,007512 kg
= 0,007512 kg
Si è ora in grado di ricavare da (4) il titolo x2 :
x2 = x1 + ![]()
![]() = 0.502
= 0.502
Ricaviamo ora il secondo volume specifico v2
nello stesso modo di (6)
v2 = 0,001058 ![]() + 0,502
+ 0,502![]()
V2 = ![]()
![]() m3
m3
A questo punto abbiamo tutti gli elementi per ottenere
l’altezza z2 finale dello stantuffo:
![]()
![]()
In
aggiunta a quanto richiesto dal problema si voglia calcolare anche
- il lavoro compiuto L
- la variazione di entropia ![]()
Per quanto riguarda il primo punto, abbiamo già tutti gli
elementi a disposizione, ricordando che è possibile ottenere il lavoro tramite
la relazione
![]() 112kg
112kg![]() 109,87 J
109,87 J
dove si ricorda che g rappresenta l’accelerazione
di gravità.
Ricordando che la variazione di entropia è pari a
![]() (7)
(7)
rimane da determinare solo l’entropia differenziale Sd,
ottenibile da
Sd
= ![]()
![]()
Quindi
dalla (7) si ha che
![]()
![]()
ESERCIZIO
DAL COMPITO DEL 28/02/2001 (SECONDO APPELLO)
3° Esercizio – Termodinamica
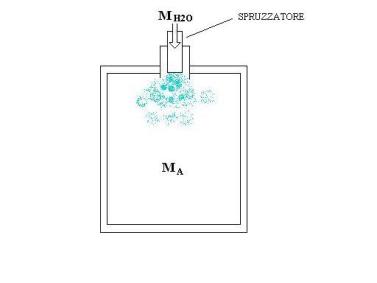
Entro un ambiente di volume V pari a 100+CD m3
si trova aria umida con temperatura T1 pari a 20+E °C ed umidità relativa ![]() pari a 30+F %.
Nell’ambiente viene introdotta un massa di acqua MH2O, alla
temperatura T1, cosicché l’umidità cresce ad un valore
pari a 30+F %.
Nell’ambiente viene introdotta un massa di acqua MH2O, alla
temperatura T1, cosicché l’umidità cresce ad un valore![]() pari a 60+F %. Ovviamente la temperatura cala, mancando
qualsiasi apporto di calore esterno. Determinare:
pari a 60+F %. Ovviamente la temperatura cala, mancando
qualsiasi apporto di calore esterno. Determinare:
-
Massa di aria secca contenuta nell’ambiente
-
Massa di acqua MH2O da aggiungere
V= 134 m3
T1= 25 °C
![]() 36%
= 0,36
36%
= 0,36
![]() 66%
= 0,66
66%
= 0,66
Consideriamo innanzitutto
che questo problema riguarda due categorie: una prima che coinvolge la sfera
dei gas perfetti ed una seconda che si riferisce alle miscele di aria e vapore.
Per calcolare infatti la massa d’aria secca contenuta inizialmente
nell’ambiente, basta ricordare l’equazione di stato dei gas perfetti nella
forma
![]()
![]()
![]() (8)
(8)
Ricavando
la pressione iniziale P1 tramite il prodotto tra il grado
igrometrico iniziale ![]() e la pressione di saturazione Psat (il cui
valore è noto dalle tabelle) ,si ha che
e la pressione di saturazione Psat (il cui
valore è noto dalle tabelle) ,si ha che
P1
= ![]()
![]()
e
si può ottenere di conseguenza anche la pressione parziale Pa tramite
la legge di Dal ton, infatti
Ptot = 101325 pa =Pa + P1 ![]() 101325 pa – 1141 pa = 100184 pa
101325 pa – 1141 pa = 100184 pa
Si
è così in grado di ottenere la massa di aria secca Ma dalla
(8)
Ma = ![]()
Si prenda ora in considerazione il
diagramma psicrometrico relativo al problema, che riporta le temperature
sull’asse delle ascisse, il titolo x sulle ordinate e sulle linee curve
l’umidità relativa ![]() in percentuale:
in percentuale:
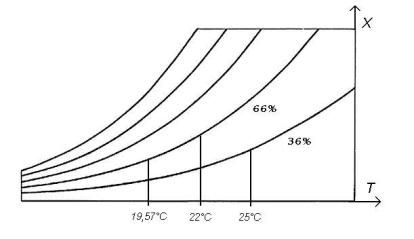
Come
si può facilmente vedere, vi è una relazione che lega il titolo x al grado
igrometrico![]() , infatti:
, infatti:
x1 =![]()
![]() (9)
(9)
in
cui Ptot rappresenta, in questo caso, la pressione
atmosferica e Ps la pressione di saturazione del vapore alla
temperatura considerata (25°C), valore che si ricava dalle tabelle. Si hanno
ora gli elementi per calcolare l’entalpia specifica dell’aria umida
![]()
![]() (10)
(10)
dove
compaiono il calore di vaporizzazione dell’acqua ro=2500![]() ed il calore specifico del vapore d’acqua cp,v=
1,9
ed il calore specifico del vapore d’acqua cp,v=
1,9![]() . Per ottenere la massa d’acqua introdotta MH2O occorrerebbe ora il titolo incognito x2 in quanto
. Per ottenere la massa d’acqua introdotta MH2O occorrerebbe ora il titolo incognito x2 in quanto
MH2O = Ma![]() (11)
(11)
ma tale titolo, come sappiamo dalla (9) è legato
alla pressione di vapore saturo alla temperatura T2, anch’essa incognita.
Procediamo allora per tentativi ipotizzando una temperatura T2
alla
quale corrisponderà una pressione di saturazione Ps ottenibile dalle
tabelle. L’attendibilità di questa prima ipotesi potrà poi essere verificata in
seguito.Cominciamo col considerare una temperatura T2 = 22°C e di conseguenza
una pressione Ps pari a 0,02642ba; il titolo x2 ricavato tramite la (9)
sarà dunque:
x2 = ![]()
In base a quanto ricavato la massa d’acqua introdotta risulta dalla (11)
MH2O = ![]()
Occorre però, a questo punto, accertarsi di essere
giunti ad un valore verosimile; per farlo ricordiamo la (10) e riscriviamola
nella forma
![]()
![]() (12)
(12)
Si
nota come l’unica incognita in tale equazione sia l’entalpia specifica J2;
ottenendola con un’altra relazione potremo poi sostituirla nella (12) e
confrontare il valore della temperatura T2 così ottenuta, con
quella che avevamo inizialmente ipotizzato di 22°C. Per fare ciò prendiamo ora
in esame la definizione di entalpia che mette in relazione la variazione ![]() di entalpia e la variazione
di entalpia e la variazione ![]() di energia interna:
di energia interna:
![]() (13)
(13)
ma
poiché l’energia, e di conseguenza l’entalpia è conservata, la (13) rimane così
formulata
![]() (14)
(14)
Scrivendo
H2 tramite l’entalpia specifica J2, si ha
che
![]()
e
allo stesso modo
![]()
dove
hL rappresenta l’entalpia specifica dell’aria umida. In
questo modo la (14) diventa
![]()
![]() (15)
(15)
Si
può ottenere il valore di hL tramite il calore specifico
dell’aria CL e la temperatura T1:
hL = ![]()
![]()
Abbiamo
a questo punto tutti gli elementi per ricavare dalla (15) l’entalpia specifica
J2 = ![]()
Andando
a sostituire questo valore nella (12) notiamo però che:
T2 = ![]()
Risulta
cioè una temperatura che si discosta sensibilmente da quella ipotizzata di
22°C. Questo significa che si è scelto un valore eccessivo ed occorre perciò
considerare una nuova temperatura T2 che sia in grado di
fornire, in questa verifica, un valore più verosimile. Si verifica (*) che tale
attendibilità si raggiunge assumendo una temperatura T2 di
circa 19,57°C, dalla quale si ricava per la (11) una massa d’acqua pari a
MH2O = ![]()
in cui il titolo x2
è sempre ottenibile dalla (9). In questo caso si ha infatti l’entalpia
specifica J2 pari a
J2 = ![]()
e riotteniamo una
temperatura T2 uguale a
T2 = ![]()
![]()
(*)
Per la verifica si rimanda alla relativa tabella di
Excel