Elisa Mori, Matr. 139434
Data:22/11/01
Orario: 14.30-16.30
I gas perfetti
Il concetto di gas perfetto è un concetto astratto che semplifica la
realtà fisica per ricondursi a casi più semplici.
Il gas perfetto, anche detto gas ideale, in natura non esiste, però alcuni gas
come l’idrogeno o l’elio, si approssimano bene al comportamento del gas
perfetto.
Si attua una schematizzazione per studiare sistemi e fenomeni che affrontati
direttamente presenterebbero notevoli difficoltà; l’introduzione del gas
perfetto ci permette di trattare in modo più semplice la teoria
dei gas nel senso che prima si studiano le proprietà di questo sistema
ideale e successivamente si vede sotto quali
condizioni può essere esteso ai gas reali.
Il gas perfetto è un gas composto da atomi elementari che non interagiscono uno
con l’altro (gli atomi non sono consapevoli della presenza degli altri) ed è
quindi molto rarefatto.
Prima di definire le leggi dei gas perfetti è necessario riprendere alcuni concetti di chimica come quello di atomo, reazione, mole.
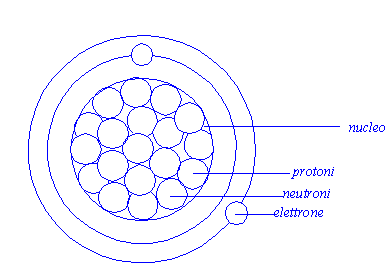
L’atomo è la parte più piccola costituente la materia,è costituita da un nucleo centrale composto da protoni e neutroni, e da una nuvola di elettroni che vi girano attorno a diverse distanze.

Gli elettroni (e-) hanno carica negativa, i protoni hanno carica positiva e ei neutroni non hanno carica, in modo che tutto il sistema risulti neutro.
|
Carica elettrica |
Massa in Kg |
|
| ELETTRONE |
-1 |
9.1 x 10-31 |
| PROTONE |
+1 |
1.6 x 10-27 |
| NEUTRONE |
0 |
1.6 x 10-27 |
Si indica con Z il numero di elettroni presenti in un atomo mentre con N si indica il numero di nucleoni, cioè la somma di protoni e neutroni, un atomo è in equilibrio quando Z=N.
Dal concetto di atomo si passa a quello
di molecola, definita come la più piccola parte di sostanza che
mantiene tutte le proprietà chimico- fisiche della stessa sostanza.
Nei gas perfetti le molecole sono indipendenti, hanno una loro massa, si muovono indipendentemente le une dalle altre, mentre nei gas reali le molecole sono legate.
Le molecole dei gas possono essere :
Monoatomiche, cioè composte da un solo atomo;
Biatomiche, composte da più atomi.
Es. L’ossigeno (O 2)è una molecola composta da due atomi.
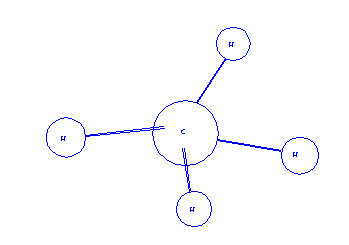
Il metano (CH4 è una molecola composta da un atomo di carbonio e quattro di Idrogeno.
Le molecole interagendo tra loro danno
luogo a reazioni chimiche.
Le reazioni chimiche combinano le molecole per crearne di nuove.
Es.La combustione del metano:
![]()
Metano e Ossigeno
si combinano per dare luogo ad anidride carbonica e acqua, inoltre viene anche
rilasciata energia.
Le molecole in questo modo si trasformano e cambiano le loro caratteristiche.
Esistono reazioni:
o
Esotermiche, dove è rilasciata energia
o
Endotermiche, dove l’energia viene sottratta
all’ambiente.
Es.
Reazione di una pila a combustione, sfrutta la reazione
chimica per dar luogo ad energia elettrica:
In un elettrolita costituito da idrossido di potassio (KOH) immergiamo due elettrodi metallici,
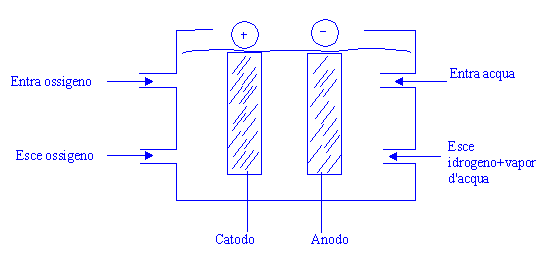
Se colleghiamo i due elettrodi a una
lampadina questa si accende, ciò significa che la reazione fornisce energia in eccesso sottoforma di energia
elettrica.
Le reazioni che avvengono su catodo e anodo rispettivamente sono:
| (+) O2 + 2H2O + 4e- ==> 4OH- | ||
 |
2H2 + O2 ==> 2H2O + E |
|
| (- ) H2 + 2OH- ==> 2H2O + 2e- |
Le molecole reagiscono e danno luogo a nuove molecole più energia.
Le reazioni possono essere reversibili, cioè valide
sia in un senso che nell’altro.
Es. La reazione nella cella elettrolitica:
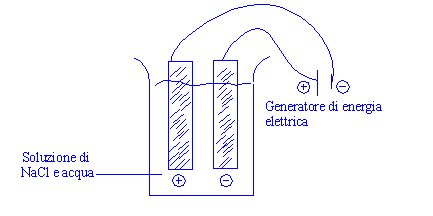
(+) 2H2O
+ 2e- ==> H2
+ 2OH-
(-) 4OH-
==> O2 + 2H2O
+ 4e-
Possiamo ora introdurre il concetto di mole , come un’altra grandezza per misurare la massa:
Mole è la quantità di sostanza (quale
che sia la sostanza) che contiene 6,02 x 1023 Molecole
della stessa sostanza
1Mol = 6,02 x 1023 molecole
dove 6,02 x 1023 è un numero costante (uguale al numero di atomi di carbonio contenuti in 0,012 Kg di carbonio 12), detto Numero di Avogadro , ed è indicato con NA.
Ricordiamo che il peso atomico equivale al peso di un atomo ed il peso molecolare equivale al peso di una molecola, ad es.:
H ha peso atomico 1, perché è composto da un protone ed un elettrone (che però ha massa trascurabile;
O2ha peso atomico 16, infatti è composto da 8 protoni, 8 neutroni e 8 elettroni.
Per l’acqua,H2O, dovrò considerare il peso molecolare (PM):
peso atomico dell’ossigeno + peso atomico dell’idrogeno --- 16 + 2 = 18
Es.
Quanto pesa 1 mole di acqua?
Il peso equivale al peso molecolare dell’acqua
espresso in grammi, quindi 18 g.
Quanto
pesa una mole di ossigeno?
Il peso
equivale al peso molecolare dell’ossigeno, cioè il peso atomico
1 Kmole = 1000 x (6.02 x 1023)molecole
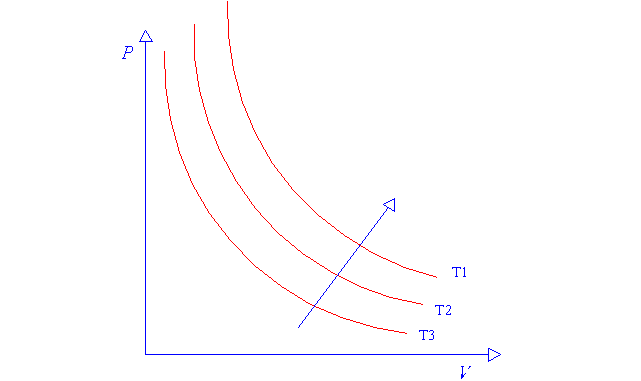
Le curve del
grafico sono dette Isoterme ed hanno un andamento ad iperbole equilatera.
In ascissa è rappresentato il volume specifico, in ordinata è espressa la
pressione assoluta.
La temperatura cresce da T3 a T1.
Se di un gas ideale conosco la temperatura e la pressione allora conosco anche la sua densità:
|
p x v = R x T |
p è la pressione
assoluta misurata in Bar o Pascal |
Tramite il numero di Avogadro ed il concetto di mole posso ricavare una formula
valida in generale per tutti i gas:
|
n = M/m |
n è il numero di moli |
Es.
Dalla precedente si ricava:
|
p x v x m = R x m x T |
v x m = v m
,volume specifico molare (cioè il
volume di una mole) |
Quindi possiamo scrivere un’equazione che valga per tutti i gas:
p x v = R0 x T
Moltiplicando
l’uguaglianza per n , numero di moli, si ha:
n x p x v m = n x R0
x T
poiché n x v m = V >,
cioè il volume totale totale, si ottiene l’equazione di stato dei gas
perfetti, espressa in funzione della temperatura assoluta :
p x V = n x R0 x T
Per poter applicare questa legge, valida
per tutti i gas perfetti, devo conoscere n e R0
= 8.315 J / mol K
Il rapporto tra R, costante variabile in
funzione del gas, ed R0 ,
costante universale valida per tutti i gas è: R = R0
/ m.
I valori di m e di R, legati dalla relazione precedente, sono
riportati, per alcune sostanze, nella seguente tabella:
| Sostanza | Formula | M Kg/KMol | R(J/KgK) |
| Acetilene | C2H2 | 26.039 | 319.43 |
| Acqua | H2O | 18.016 | 461.70 |
| Ammoniaca | NH3 | 17.032 | 488.38 |
| Anidride Carbonica | CO2 | 44.012 | 188.99 |
| Anidride Solforosa | SO2 | 64.066 | 129.83 |
| Argon | Ar | 39.950 | 208.21 |
| Aria | 28.968 | 287.13 | |
| Azoto | N2 | 28.014 | 296.91 |
| Elio | He | 4.0028 | 2078.0 |
| Etano | C2H6 | 30.71 | 276.60 |
| Etilene | C2H4 | 28.055 | 296.48 |
| Freon | 12CCl2F2 | 120.914 | 68.77 |
| Idrogeno | H2 | 2.0158 | 4126.4 |
| Metano | CH4 | 16.044 | 518.46 |
| Neon | Ne | 20.184 | 412.10 |
| Ossido di Carbonio | CO | 28.012 | 296.93 |
| Ossido di Azoto | NO | 30.007 | 277.19 |
| Ossigeno | O2 | 31.891 | 260.83 |
| Propano | C3H8 | 44.097 | 188.55 |
Es. L’aria,
che è una miscela costituita per 75% da azoto e per il 25% da ossigeno , si
considera come un gas perfetto: R = R0
/ mARIA
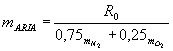 |
= 286,7 J / Kg K |
Un gas perfetto è tale solo se soddisfa esattamente alla legge di Boyle ed alle
due leggi di Gay-Lussac:
| Legge di Boyle |
A temperatura costante, il volume di una massa di gas è inversamente proporzionale alla sua pressione P x V = cost per
T costante. |
|
Prima Legge |
1) In tutti i gas, mantenendo costante la pressione, a ogni determinato aumento di temperatura corrisponde lo stesso aumento di volume: V r =
V0 ( 1 + αT)
per p costante V0 è
il volume iniziale del gas alla temperatura
di 0°C Se volessimo esprimere l’equazione in gradi Kelvin, sarebbe:
V r = V 273 K (
1+ αΔT) |
|
Seconda Legge |
2)In tutti i gas, mantenendo
costante il volume, a ogni determinato aumento di temperatura corrisponde lo stesso aumento di pressione P
r = p
0 ( 1+ αT) per V
costante
|
Una delle più importanti caratteristiche dei gas ideali è che l’energia
interna (u) e l’entalpia (h) sono funzioni solo della temperatura e sono
completamente indipendenti dalla pressione.
Ricordiamo dalle lezioni precedenti che :
![]()
![]()
Nel caso dei gas ideali avremo:
|
CP = Δu/ΔT |
CP è il calore specifico a pressione costante Δu è la variazione di energia interna ΔT è la variazione di temperatura |
|
CV = Δh/ΔT |
CV è il calore specifico a volume costante Δh è la variazione di entalpia ΔT è la variazione di temperatura |
Nel caso del gas perfetto i calori specifici a volume o pressione costante non
variano mai insieme ma sempre uno indipendentemente dall’altro:
![]()
queste differenze sono sempre uguali all’interno
della sostanza ma variano a seconda
del tipo di gas si consideri.
Definiamo anche: γ
= Cp / Cv
e diamo alcuni valori di calori specifici per diverse sostanze:
|
Sostanza |
Cp in Kj/Kg k |
Cv in Kj/Kg k |
|
Acqua |
0.44 |
|
|
Aria |
1.01 |
0.717 |
|
Idrogeno |
14.2 |
10.1 |
|
Ossigeno |
0.917 |
0.656 |
Una volta scritte le definizioni di Cp e Cv posso
ricavare quanto vale Δu
e Δh
:
![]()
![]()
La terza grandezza da prendere in
considerazione insieme all’energia interna e all’entalpia è l’entropia ,
la cui variazione è stata definita nelle lezioni precedenti come il rapporto
tra variazione di calore e temperatura; si può ricavare attraverso metodi di
integrazione la relazione che esprime questa grandezza per i gas perfetti:
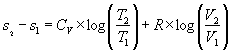 |
|
oppure |
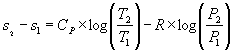 |
Nel diagramma dei gas perfetti si possono trovare anche curve adiabatiche, cioè
curve che esprimono trasformazioni i cui scambi di calore sono talmente veloci
da poter essere considerati trascurabili:
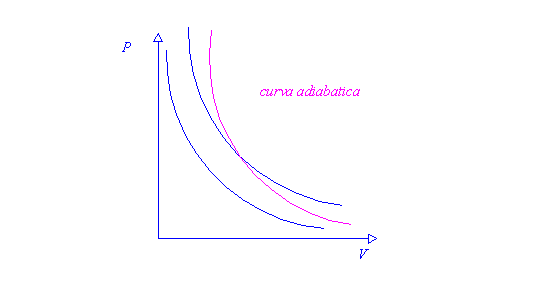
La relazione che vale per le trasformazioni adiabatiche è:
p x vγ = cost
Se la trasformazione adiabatica avviene in modo reversibile, cioè se = 0, si hanno così delle curve in cui l’entropia rimane costante.