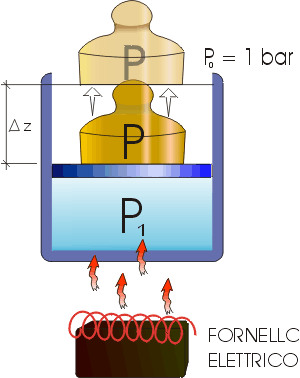
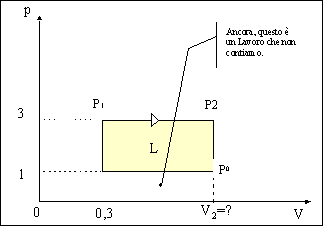
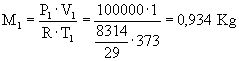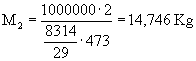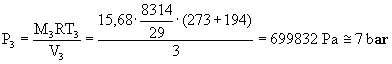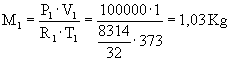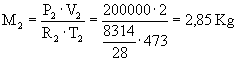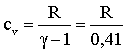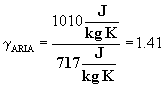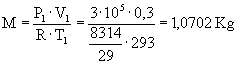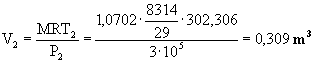Fausto Ugozzoli – matr. 133200
– Lezione del 10/11/00 – ora 10:30-12:30
Esercizi sui gas perfetti.
Esercizio 1.
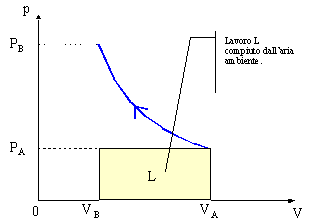
Vediamo il problema della miscelazione di due gas differenti all’interno di
uno scatolone adiabatico (= recipiente isolato dall’esterno mediante
pareti coibentate).
Q =
0 (essendo un sistema adiabatico, non avvengono scambi di calore con
l’esterno)

Fig.1 – scatolone adiabatico.
Nota 1: Con 1 e 2 sono indicati i due sistemi. Il setto interno al recipiente, è
posto verso sinistra a causa della differenza di pressione tra i due gas.
Nota 2: L'aria è un miscuglio di vari gas, costituito soprattutto da azoto e ossigeno che ne rappresentano circa il 99% del volume. L'aria ha la stessa composizione in regioni e altitudini diverse se non si considerano il vapor d'acqua, il biossido di carbonio, l'ozono, l'ammoniaca, le eventuali polveri e i microbi che per diverse ragioni possono essere presenti in quantità variabili. L'aria priva di essi è detta aria pura e la sua composizione volumetrica è: 20,95% di ossigeno, 78,09% di azoto, 0,94% di argo e gas rari.
Nota 3: Gas perfetto, è un ipotetico gas che
segue le leggi di Boyle-Mariotte e di Volta-Gay-Lussac. Un gas si dice gas
perfetto se soddisfa all'equazione pv = nRT dove n è il
numero delle moli presenti, R è la costante dei gas perfetti pari a
8,314 joule/mole K, T è la temperatura assoluta che è legata alla
temperatura t della scala centigrada dalla relazione T = t +
273,16.
Per trasformazioni isoterme l'equazione precedente si riduce alla legge
di Boyle-Mariotte che stabilisce la proporzionalità inversa tra pressione e
volume per un gas perfetto. L'equazione di stato dei gas perfetti si può
ricavare per via teorica, mediante la teoria cinetica dei gas, nelle ipotesi
che il volume proprio delle molecole e le loro mutue interazioni siano
trascurabili. Queste due condizioni si verificano senz'altro per un gas in uno
stato molto lontano dal suo punto di liquefazione. Quindi tutti i gas a
temperature sufficientemente elevate e a pressioni sufficientemente piccole si
comportano come gas perfetti.
Dati:
V1=1
m3 V2=2
m3 T1=100
°C T2=200
°C P1=1
bar P2=10
bar
![]()
|
Rimuovendo il setto i gas
si mescolano: |
|
Fig.2 – scatolone adiabatico allo stato finale. |
Lo stato fisico finale, di equilibrio, si otterrà dopo un periodo di “assestamento”.
Cerchiamo,
ora, di ottenere i seguenti dati, calcolati allo stato finale: ![]()
Chiaramente
V3 = 3m3.
Trovando la temperatura T
, la pressione P è facilmente ricavabile dall’equazione di stato dei gas
perfetti.
Utilizzando il 1°
principio della termodinamica otteniamo: UFIN - UIN = Q
- L = 0