Università degli Studi di ParmaFacoltà di IngegneriaElettronica
Corso di FISICA TECNICA
Prof. Angelo Farina
Anno Accademico 1998/99
Martedì 6/10/1998 - 3° lezione8.30-10.30
Trascritta da Alessandro Menozzi Mtr. 076218
I PRINCIPIO DELLA TERMODINAMICA
In modo molto semplice il I Principio della termodinamicapuò essere enunciato come un principio di conservazionedell'energia, nel seguente modo:
l'energia non si crea ne si distrugge.
Il principio, in quanto tale, è sempre vero, anche seprendiamo in considerazione un sistema in cui avvengono interazioninucleari. In questo caso infatti solo apparentemente si osservacreazione di energia dal nulla; in realtà sappiamo che lateoria della relatività di Einstein ha esteso il principiodella conservazione dell'energia in un principio di conservazionedell'energia e della massa secondo la relazione:
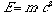
In ogni caso noi non considereremo mai interazioni di tiponucleare o chimico.
Definizioni:
- si definisce come sistema S una regione dello spazio delimitata da una superficie di confine chiusa o aperta. Il sistema S può essere fermo o in movimento rispetto al sistema di riferimento scelto.
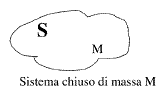
- Se la superficie di confine è chiusa la massa del sistema è costante; non solo, se potessimo marcare le molecole presenti nel sistema ad un dato istante, queste rimarrebbero sempre le stesse anche dopo un tempo t arbitrario. Si parla di costanza della massa come individualità.
- tutto ciò che si trova al di fuori di un sistema chiuso prende il nome di contorno o ambiente del sistema.
| Esempio: |
| consideriamo il caso di un cilindro all'interno del quale si trova un pistone:
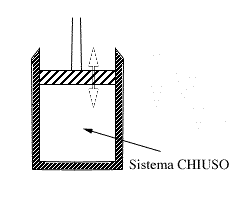 si tratta di un sistema chiuso, il cui contorno è delimitato dalle pareti del cilindro e dalla superficie del pistone. In questo caso la superficie può essere deformata semplicemente alzando o abbassando il pistone. si tratta di un sistema chiuso, il cui contorno è delimitato dalle pareti del cilindro e dalla superficie del pistone. In questo caso la superficie può essere deformata semplicemente alzando o abbassando il pistone.
|
Tra il sistema (chiuso o aperto) e l'ambiente circostante sipossono avere scambi energetici, che avvengono attraverso la "pelle"del sistema.
Il I Principio della Termodinamica permette di quantificarel'entità con cui avvengono questi scambi. Vedremo innanzituttouna formulazione del I Principio valida per i soli sistemi chiusi,considerando solo in un secondo momento sistemi aperti in cui vipossono essere variazioni di massa.
 SistemaAperto
SistemaAperto
Sistemi chiusi.
- Come abbiamo già osservato, in questo caso la massa M del sistema non varia. Può essere utile riferire tutte le grandezze in rapporto alla massa M.
- Definiamo come volume specifico v il rapporto del volume V con la massa M racchiusa dallo stesso; analogamente si definisce la pressione specifica:

Il volume specifico v è una grandezza intensiva.
- Ricordiamo infatti che una grandezza si dice INTENSIVA quando il proprio valore numerico non dipende dalla quantità di materia considerata.
- Quindi il volume V è invece una grandezza ESTENSIVA, il cui valore dipende dalla quantità di materia considerata.
- Un'equazione in cui compaiono delle grandezze fisiche estensive è sempre valida anche se introduciamo le corrispondenti grandezze intensive: quest'ultime si ottengo dividendo semplicemente ambi i membri per la massa M.
- Ad esempio l'equazione di stato dei gas perfetti
p V = M R T
può essere scritta anche in forma intensiva, introducendoil volume specifico v:
p v = R T
- Torniamo al nostro sistema chiuso e consideriamo due istanti t1 e t2 (non infinitesimi). Siano E1 e E2 l'energia posseduta dal sistema rispettivamente all'istante t1 e t2, e valutiamo in che modo può variare l'energia del nostro sistema.
- All'interno del contorno non può essere prodotta alcuna energia (sistema chimicamente inerte e assenza di interazioni nucleari), quindi se accade che E2>E1 significa che il sistema ha acquistato necessariamente energia dall'ambiente esterno.
- L'energia al sistema può essere fornita dall'ambiente esterno attraverso numerosi modi. Ad esempio attraverso una resistenza elettrica immersa nel sistema ed alimentata da un generatore di corrente, da un motore elettrico che mescola il contenuto del sistema, o ancora da un fornello che riscalda il sistema ecc.
In ogni caso tutte queste forme energetiche sono semprericonducibili a due tipi principali:
- energia di tipo calore Q;
- energia di tipo lavoro L.
Per un sistema CHIUSO non reagente, escludendo interazioni di tiponucleare, possiamo dare il seguente enunciato formale del IPrincipio della Termodinamica:
E2 - E1 = Q - L
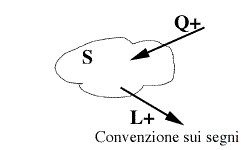
- Per convenzione si considerano le interazioni di tipo calore Q positive se apportano energia al sistema, e le interazioni di tipo lavoro L positive se sottraggono lavoro al sistema.
- Osserviamo come le uniche interazioni che compaiono nel I principio riguardano solo quelle di tipo calore o lavoro che avvengono tra ambiente esterno e sistema (non compaiono quindi eventuali scambi di calore e lavori interni al sistema).
- Infatti l'equazione rappresenta un bilancio della "pelle" del sistema e interessano solo i flussi energetici che l'attraversano.
Energia Interna U.
- Il sistema puo "contenere" energia sotto varie forme.
- Ad esempio un sistema costituito da una pallottola acquisisce energia cinetica
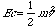 nel momento in cui viene sparata dalla canna di una pistola, così come invece un sistema costituito da un pallone riempito di gas acquisisce una certa energia potenziale Ep=mgz mano mano che si alza in cielo.
nel momento in cui viene sparata dalla canna di una pistola, così come invece un sistema costituito da un pallone riempito di gas acquisisce una certa energia potenziale Ep=mgz mano mano che si alza in cielo. -
- L'esperienza di tutti i giorni evidenzia che oltre a queste due forme di energia meccanica, debbano necessariamente esistere altre. Se mettiamo un pentolino pieno d'acqua sul fuoco e portiamo l'acqua all'ebollizione, notiamo che non varia Ec e neppure Eg, nonostante il fatto che sia stato fornito del calore al sistema.
- Risulta definita una terza forma energetica che prende il nome di energia interna U:
| Ec + Eg + U = E | - Ec = energia cinetica
- U = energia interna
- Eg = energia potenziale
-
- E = energia totale del sistema
|
Nel 90% dei casi i contributi dovuti a Ec e Ep sono trascurabilirispetto al valore di enrgia interna U ed il I Principio puòessere scritto:
U2 - U1 = Q - L
o ancora, utilizzando le grandezze intensive (dividendo perM):
| u2 - u1 = q - l |  |
Nei processi rapidi invece di avere degli intervalli di tempofiniti t2-t1 si ha a che fare con delle grandezze infinitesime(dt e dE.) e si è soliti scrivereil I Principio in forma differenziale:
du = dq - dl
A tal proposito è bene osservare come in realtà sitratta di un "abuso" matematico. Infatti a rigore è lecitoscrivere il differenziale delle sole funzioni (o variabili) distato, ovvero di quelle funzioni i cui valori sono indipendentidal cammino considerato.
Stato fisico del Sistema.
Le funzioni di stato sono rappresentate da proprietàfisiche della materia in cui valore non dipende dalla "storiapassata" ma solo ed esclusivamente dal suo stato fisicoattuale.

Lo stato fisico di un sistema può essere definito in modooperativo. A tale scopo il sistema che si considera deve esseresufficientemente piccolo ed omogeneo: in tutti i punti del sistema legrandezze intensive p, v eu devono coincidere e nonvariare. Questo equivale a imporre che le grandezze intensive sianodelle funzioni di stato.
Il concetto è comunque generalizzabile al caso di unsistema qualunque, supponendo di scomporlo in tanti sotto-sistemifiniti omogenei.
Per un sistema chiuso monocomponente e non reagente il numerominimo di funzioni di stato necessarie a definirne univocamente lostato è 2.
Le funzioni necessarie a definire in modo completo lo stato fisicodi un sistema prendono il nome di coordinatetermodinamiche.
| 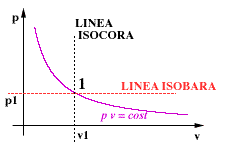
| -
Definito lo stato 1 rimangono definite le funzioni di stato p e v. - Infatti l'equazione di stato PV = MRT lega tra di loro le funzioni di stato P eV.
- Le coordinate termodinamiche sono 2.
I punti appartenenti alla linea isobara (a pressione costante) cono detti punti isobari; quelli appartenenti alla linea isocora (a volume costante) sono chiamati punti isocori. |
La regola delle fasi di Gibbs.
- Spesso su molti libri viene riportata la regola delle fasi di Gibbs e si dice che essa definisce la varianza V come il numero di variabili indipendenti necessarie per definire completamente lo stato di un sistema in equilibrio.
- Se intesa in questo modo la regola delle fasi di Gibbs non ha alcun valore ed è bene osservare che la varianza non coincide con il numero di coordinate termonidamiche!
-
- Regola di Gibbs:
-
- V = C - F + 2
-
- V = varianza
- C = componenti
- F = fasi
| Esempio |
| Tenendo presente che le coord. termodinamiche per un sistema chiuso sono 2, vediamo quanto vale la varianza in alcuni casi: - consideriamo un sistema chiuso ne quale sono presenti 1 componente (H2O) e due fasi (liquida e gasosa). Per la legge di Gibbs:
- V=1-2+1= 1
-
- Per lo stesso sistema in cui però siano presenti 3 fasi (liquida e gasosa e solida = punto triplo dell'H2O) la legge di Gibbs diviene:
- V=1-3+2= 0
-
- Considerazioni analoghe possono essere fatte considerando sistemi a più componenti:
- la varianza di un sistema chiuso rappresenteto da una miscela gassosa di O2 e N2 (sono i due componenti principali dell'aria che respiriamo) risulta:
- V=2-1+2= 3
-
- mentre sappiamo che sono sufficienti 2 sole coordinate termodinamiche (essendo un sistema chiuso non puo variare ne la massa M e quindi la miscela gassosa e possono variare liberamente solo la temperatura, la pressione ed il volume).
|
- La regola delle fasi è quindi inutile.
- In realtà infatti la varianza che risulta dalla regola delle fasi di Gibbs è da interpretarsi come il numero di gradi di libertà che possono esistere tra le variabili termodinamiche. La regola delle fasi non stabilisce però quali siano le variabili interessate.
-
-
-
- Esperienza (legge) di Joule.
-
- Anche l'energia interna U è una funzione di stato, ed è stato dimostrato per la prima volta sperimentalmente da Joule.
- Si consideri una trasformazione ciclica compiuta da un sistema costituito da un gas:
- dallo stato fisico 1 allo stato fisico 2 lungo il percorso a , e di ritorno allo stato 1 lungo il percorso b.
-
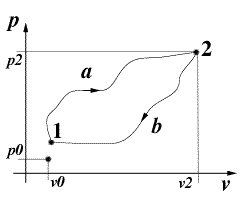
-
- Joule ha valutato le quantità Q e L scambiate lungo le due trasformazioni ed ha osservato che nonostante ne Q ne L siano funzioni di stato lo è la loro differeza Q-L, ovvero:
-
- Qa-La = Qb-Lb
-
a, b percorsi qualsiasi.
Quindi l'energia interna U è una funzione di stato:l'en. interna U2 del sistemaquando questo si trova nello stato 2 dipende solo ed esclusivamenteda p2 ev2.
Sperimentalmente è possibile ricavare la variazioneU2-U1,mentre il valore assoluto dell'energia interna U è notosolo a meno di una costante. Questa si sceglie fissando un'opportunacoppia di valori p0 ev0, solitamentecoincidenti al punto triplo dell'H2O.
-
-
- Calori specifici.
- Si definiscono le seguenti grandezze fisiche:
-
Entalpia H.
- Un altro modo per esprime l'energia interna, che torna comodo spesso nell'equazione di bilancio dei sistemi aperti è quello che utilizza l'entalpia H:
- Per definizione:
H = U + pV
- Ricorndando che U, p, V sono tutte funzioni di stato, segue immediatamente che anche H é una funzione di stato.
-
- Dal I Principio in forma differenziale du = dq - dl = ct dT -dl , quindi:
-
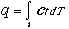
ct dipende dal cammino,quindi non può essere estratto dal segno di integrale, ovverodq non è undifferenziale esatto. In modo analogo si trova che anchedl non è undifferenziale esatto.
Al contrario però la divverenza dq - dlè un differenziale esatto! quindi
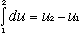
-
- Per la soluzione dell'integrale ipotizzando di conoscere l'apportodq , per quanto riguarda dl devo rcavarne un'espressione opportuna.
-
| 
| -
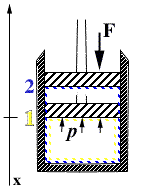
- A tale scopo posso considerare una trasformazione quasi statica (per successivi stati di equilibrio) che avviene all'interno di uno stantuffo pieno di gas.
Inizialmente all'equilibrio deve essere necessariamente F = p A , con A che sta ad indicare l'area del pistone. Supponiamo di fare compiere una trasformazione che comporti un'aumento della pressione interna p. - Affinché il sistema possa compiere una trasformazione quasi statica la pressione deve crescere di infinitesimi. Ne segue che la componente dinamica della trasformazione può essere ragionevolmente ritenuta trascurabile, ed ancora rimane valida l'equazione
- F = p A.
- Possiamo scrivere:
- L = F x (lavoro totale)
- dL = F dx = p A dx = p dV
-
- da cui l'espressione ricercata di dl
- dl = p dv
|
- e quindi
- du = dq - p dv
Osserviamo subito che il lavoro è identificabile nel diagramma P V, come l'area sottesa dal percorso della trasformazione in esame. Cicli che "girano" in senso orario producono un lavoro positivo; viceversa se avvengono in senso antiorario producono un lavoro negativo. In un ciclo: Q = L (E2 - E1 = Q - L) ovvero nel caso in fig.2,il calore netto entrato nel ciclo eguaglia il lavoro fornito dal sistema: Qb - Qb = L In accodo al I principio (dal quale si è derivata quest'ultima eguaglianza) non può esistere alcuna macchina in grado di produrre più energia rispetto a quella che riceve. Il moto perpetuo di I specie viola il I principio della termodinamica. | 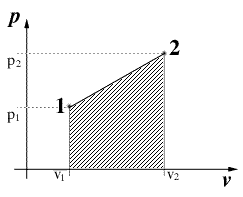
Fig.1
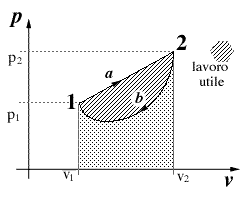
Fig.2 |
-
Alessandro Menozzi: amenozzi@usa.net

 SistemaAperto
SistemaAperto![]()


![]()