Argomento della lezione :
ESERCIZIO N°1 : LO SCATOLONE ADIABATICO
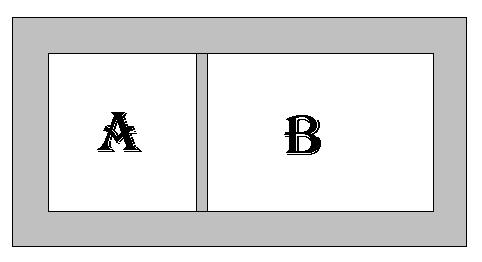
Il recipiente contiene vapor d’acqua surriscaldato A e B . I due vapori sono separati tra di loro da un isolante . Sappiamo che MA=1 Kg , MB=2 Kg , PA=9.8 BAR , PB=0.98 BAR , XA=0.1 , XB=0.5 .
In un secondo momento viene tolto il setto che divide due vapori, si chiede di studiare lo stato finale di questo sistema chiuso (cioè titolo, pressione e anche variazione di entropia)
-
RISOLUZIONE DEL PROBLEMA
Questo è un problema a volume costante, in cui non c’è scambio di calore . Per ciò l’energia interna del sistema finale si conserva.
UC = UA + UC (1)
Inoltre osserviamo che il fenomeno non è lineare , non si può trattare con le leggi dei gas perfetti.

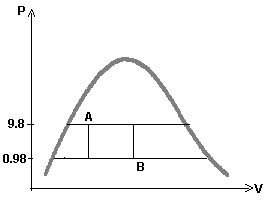
Osservando il classico grafico PV si vede subito che la soluzione sarà dentro il rettangolo delimitato da A e B. Non essendo il fenomeno lineare non troverò la soluzione sulla retta che unisce i due punti.
Osserviamo ora che in generale vale che :
U = M *( uL + XA* uD) ( 2 )
Allora la ( 1 ) si può riscrivere come :
UC = MA * ( uLA + XA* uDA) + MB * (uLB + XB * uDB ) ( 3 )
Ricaviamo ora uA e uB dalla opportuna tabella in funzione della pressione :
|
° C |
P (BAR) |
vD M3/Kg |
hL KJ/Kg |
r KJ/Kg |
sL KJ/(Kg*K) |
vL M3/Kg |
|
70 |
0.3116 |
5.046 |
292.97 |
2334.0 |
0.9548 |
0.001022 |
|
80 |
0.4736 |
3.409 |
334.92 |
2308.8 |
1.0753 |
0.001029 |
|
90 |
0.7011 |
2.361 |
376.94 |
2283.2 |
1.1925 |
0.001036 |
|
100 |
1.0133 |
1.673 |
419.06 |
2256.9 |
1.3069 |
0.001043 |
|
150 |
4.760 |
0.3924 |
632.15 |
2113.2 |
1.8416 |
0.001090 |
|
155 |
5.433 |
0.3464 |
653.78 |
2097.4 |
1.8923 |
0.001096 |
|
160 |
6.181 |
0.3068 |
675.47 |
2081.3 |
1.9425 |
0.001102 |
|
165 |
7.008 |
0.2724 |
697.25 |
2064.8 |
1.9923 |
0.001108 |
|
170 |
7.920 |
0.2426 |
719.12 |
2047.9 |
2.0416 |
0.001114 |
|
180 |
10.027 |
0.1938 |
763.12 |
2013.1 |
2.1393 |
0.001127 |
|
190 |
12.551 |
0.1563 |
807.52 |
1976.7 |
2.2356 |
0.001415 |
Siccome noi conosciamo la pressione possiamo ricavare da questa tutti i dati termodinamici e sfruttare la (3) per ricavare UC ( ricorda che hL = uL e uD = r - P * vD )
uA = 763.12 + 0.1 * (2013 - 981* 0.1938 ) = 941 KJ/Kg
uB = 419.06 +0.5 * (2256.9 - 98.1 * 1.673 ) = 1460 KJ/Kg
uC= ( MA * uA + MB * uB ) / MC = ( 2* 1460 + 941) / 3 = 1287 KJ/kg
Sfruttando la tabella possiamo ricavare anche il volume occupato dalla nota relazione :
v = vL + x* vD (4 )
Dalla (4) si ha vA = 0.0208 m3/ Kg e vB = 0.863 m3/ Kg
Moltiplicando per la massa è ora facile ricavare il volume totale iniziale che sarà ovviamente uguale al volume finale :
VA = vA * MA = 0.0208 m3/ Kg
VB = vB * MB = 1.726 m3/ Kg
VC = VA + VB = 1.7468 m3/ Kg
vC = VC / MC = 0.582 m3/ Kg
Abbiamo così ricavato il volume specifico e l’energia interna dello stato finale ; dobbiamo ora cercare pressione e titolo. Restano sempre valide per lo stato C la (4) e la (2), perciò :
Queste sono due equazioni la cui unica vera incognita è XF. Le altre grandezze si troveranno su una riga della tabella dell’acqua. In questi casi comunque non è possibile attuare una soluzione algebrica, useremo allora un metodo ingegneristico che consiste nel procedere per tentativi fino a che il sistema non è soddisfatto. Indicativamente sappiamo che la pressione sarà compresa tra 9.8 BAR e 0.98 BAR
Il risultato finale è P = 1.20 BAR e X = 0.40
Calcoliamo la variazione di entropia :
D S = MC*sC - ( MA * sA + MB * sC ) (5)
sA =sL + rA / TA = 2.1393 + 0.1 * 4.443 = 2.58
sB = sL + rB / TB = 1.312 + 0.5 * 6.022 = 4.323
sc = sL + rC / TC = 1.352 + 0.4 * 5.996 = 3.750
Dalla (5) si ha che D S = 3 * 3.750 - 2.58 -2 * 4.323 = 0.03 kJ / K
ESERCIZIO N°2 :
In un tubo gira acqua alla pressione di 1 BAR e alla temperatura di 100°C. Si vuole conoscere la percentuale di vapore e liquido presenti nel tubo ( oppure il titolo X ) e per questo si fa gorgogliare da un piccolo ugello l’acqua in un calorimetro dove inizialmente la temperatura è di 25°C. La massa d’acqua nel calorimetro prima che l’acqua gorgogli è M1 = 0.570 Kg ; la massa d’acqua finale è MF = 0.615 Kg
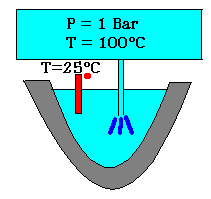
Osserviamo innanzitutto che il processo avviene a pressione costante di 1 BAR perché il calorimetro è a cielo aperto. Allora si conserva l’entalpia del sistema essendo : dh = dq + v * dp = dq (1)
Allora H3 = H1 + H2 (2)
H3 è lo stato finale del sistema dove resta solo acqua liquida ad una temperatura compresa tra 100°C e 25°C. H1 è l’entalpia dell’acqua liquida presente all’inizio del processo e H2 è l’entalpia del vapore umido all’inizio del processo (alla fine non ci sarà vapore). Ricordiamo poi che l’entalpia nel campo del liquido sottoraffreddato non varia
H3 = MF * CP * TF = (0.615) * 4.1886 * 64 = 164.86 KJ ( 3 )
H2 = M1 * CP * 25 = ( 0.570 ) * 4.1186 * 25 = 59.68 KJ ( 4 )
H1 = ( MF - M1 ) * ( hL + X 1 * r1 ) = 0.045 * ( 419 + X * 2257 ) = 18.855 + 101.5 * X ( 5 )
E’ da notare che H3 e H2 sono stati trattati come liquidi e H1 come vapore saturo.
Da quest’ultime equazioni si può ricavare facilmente il titolo X= 0.85
In generale comunque i calorimetri non vengono utilizzati nelle industrie per il costo elevato e perché funzionano unicamente a pressione atmosferica.