BASI CONCETTUALI DELLA TERMODINAMICA
Il termine termodinamica indicava in origine lo studio del calore ed è stato poi allargato ad includere lo studio della trasformazione dell’energia in tutte le sue forme. La termodinamica si basa su alcuni postulati che costituiscono i principi della termodinamica. Il primo, il principio zero, fu formulato attorno al 1931; si riferisce alla possibilità di definire la temperatura di un oggetto. Il concetto di temperatura è uno dei più profondi della termodinamica. Come il tempo è la variabile fondamentale della dinamica, la temperatura è la variabile fondamentale della termodinamica. Consideriamo per il momento, la temperatura come un affinamento e un’espressione quantitativa della nozione di “calore”.
Il primo principio è generalmente
enunciato come ”l’energia si conserva”. Il fatto che sia
l’energia che si conserva, e non il calore, fu il concetto fondamentale
compreso negli anni 1850. In effetti, l’emergere dell’energia come concetto
unificatore fu uno dei maggiori successi della scienza del diciannovesimo
secolo. L’energia infatti spodestò dalla sua posizione centrale
l’apparentemente più tangibile concetto di “forza” che era stato considerato il
concetto unificatore.
Poniamo ora la nostra attenzione sull’energia e sulle
sue molteplici forme.
Energia
L’energia è una grandezza fisica che esprime la capacità di un sistema di compiere lavoro. Sotto questi termini il lavoro si riferisce quindi al trasferimento di energia che interviene quando un corpo, sotto l’azione di una forza, si sposta lungo la direzione di questa. Si è in presenza di un lavoro per esempio quando una molla elastica viene allungata o quando il gas in un cilindro viene compresso.
Se lo spostamento S e la forza F hanno la stessa direzione, il lavoro L calcolato come:
(1)
L = FS
è positivo e l’oggetto acquista energia; quando invece forza e spostamento hanno verso opposto il lavoro risulta negativo e il corpo perde energia.
Dimensionalmente l’unità di misura del lavoro è data
da un’unità di forza moltiplicata per un’unità di spostamento. Nel sistema
internazionale il Joule (J) è il prodotto di un newton per un metro.
La potenza è la rapidità con cui viene compiuto
lavoro; in altre parole, la misura della quantità di lavoro che può essere
effettuata nell’unità di tempo. Poiché il lavoro equivale, in un determinato
processo, all’energia che viene trasformata in quel processo, si può dire che
la potenza rappresenta la rapidità con cui viene trasformata l’energia. La
potenza viene misurata nel Sistema Internazionale in Watt (W=1J/1s) ma
un’altra unità di misura assai diffusa è il Cavallo Vapore (1CV=735,5
W).
Tipi di energia
Nell’ambito puramente meccanico si distinguono due diverse forme di energia: un corpo in movimento possiede un’energia cinetica per effetto del moto (Ec = mv2) e può possedere una determinata quantità di energia potenziale in relazione alla posizione che esso occupa all’interno di un campo di forze conservativo, ad esempio il campo gravitazionale.
Nel corso del moto in un campo di forze, l’energia potenziale si trasforma in energia cinetica e viceversa, ma la loro somma è costante. Così, un pendolo oscillante ha energia potenziale massima agli estremi dell’oscillazione, possiede energia cinetica e potenziale in porzioni variabili nei punti intermedi, e raggiunge il valore massimo di energia cinetica nei punti di elongazione minima.
In generale, l’energia esiste in molte forme diverse che possono trasformarsi in parte o totalmente l’una nell’altra: si parla infatti di energia termica, chimica, elettrica, di radiazione e atomica.
Tali forme di energia sono definite di “Serie A”, perché sono di alta qualità e alto valore economico. Mentre un’energia di bassa qualità e altrettanto basso valore economico, e per questo definita di “Serie B”, è il calore (Q).
Il calore è una forma di energia che spesso viene prodotta quando si creano altri tipi di energia. Il motore di un’auto si scalda quando è in moto e per evitare che si surriscaldi è necessario utilizzare un sistema di raffreddamento. Quando si accende una lampadina si genera sia luce sia calore: il calore prodotto viene sprecato, perché non può essere usato. Quindi è impossibile convertire il calore in altre forme di energia.
In fisica si adotta per il calore la stessa unità di misura valida per il lavoro e l’energia, cioè il Joule.
Nel XIX secolo si scoprì che l’energia può essere trasformata ma non creata ne distrutta. Questa affermazione, conosciuta come principio di conservazione dell’energia, sta alla base del primo principio della termodinamica.
Sistema Termodinamico
Per poter definire e applicare il primo principio è necessario introdurre la definizione di sistema termodinamico.
Un sistema è una porzione di spazio delimitata da una superficie, chiamata anche “pelle” del sistema, che separa un ipotetico “interno” dall’esterno.
Il complementare di un sistema termodinamico è l’ambiente, definito semplicemente come l’insieme di ciò che non appartiene al sistema.
L’unione di sistema e ambiente è chiamato universo. Ed è all’universo che il primo principio della termodinamica si riferisce.

Figura a - Sistema+Ambiente=Universo
Le
proprietà del sistema vengono esaminate in due soli istanti: Il “prima” e il
“dopo” del processo, senza prendere in considerazione gli stati intermedi, che
non hanno alcuna rilevanza ai fini dello studio del processo.
Un sistema termodinamico può essere:
· CHIUSO se non scambia materia con l’ambiente; in questo caso il suo contenuto rimane costante, quindi la sua massa risulta invariante.
· APERTO se vi è flusso di materia attraverso la superficie del sistema, cioè attraverso aperture in cui si ha passaggio di massa.
Un esempio di sistema chiuso sono le masse d’aria; un sistema aperto può essere ben rappresentato dal serbatoio di un’auto.
Prendiamo in considerazione un sistema termodinamico chiuso dotato di una energia iniziale E1 (in una qualsiasi forma); sia E2 l’energia finale del sistema tale che E2 > E1.

Figura b-
Passaggio di un sistema dallo stato 1 allo stato 2 ad energia maggiore
Voglio fare ora un bilancio energetico tra il “prima” e il “dopo” :
(2)
E2 – E1 = Esc
Dove Esc rappresenta
l’energia scambiata dal sistema.
Da queste considerazioni deduco che una certa
quantità di energia è entrata nel sistema. Quindi arrivo alla conclusione che,
escludendo il trasporto convettivo, l’energia può passare attraverso la
superficie di un sistema termodinamico chiuso.
Nella termodinamica i trasferimenti di energia tra
sistema e ambiente vengono ricondotti a due categorie:
·
LAVORO
(mediante la deformazione della superficie)
·
CALORE
Calore (Q) e lavoro (L) sono due modalità di trasferimento di energia che non implicano trasporto di materia.
In termodinamica si adottano le seguenti
convenzioni:
Þ Il lavoro L effettuato dal
sistema sull’ambiente è assunto come positivo
Þ Il calore Q fornito
dall’ambiente al sistema e positivo.
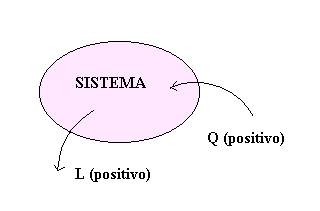
Figura c
- Convenzione segni calore e lavoro
PRIMO PRINCIPIO PER SISTEMI CHIUSI
Dato un sistema con energia iniziale E1, energia finale E2, con E2 > E1
si
ha che
(3)
E2 – E1 = Q – L
Questa formula può essere interpretata in questo modo:
l’eventuale incremento di energia di un sistema è dato
dalla differenza tra calore fornito al sistema e lavoro effettuato dal sistema
stesso.
La termodinamica, con il primo principio, introduce
una nuova modalità di immagazzinamento dell’energia: l’energia interna
(indicata normalmente con U): essa è legata allo stato microscopico
della materia ed è la risultante a livello macroscopico del frenetico agitarsi
dei sui componenti elementari (atomi e molecole). Per facilitarne l’intuizione
si può dire che l’energia interna per unità di massa di un corpo è legata
strettamente alla sua temperatura e, con minor rilevanza, alla sua pressione.
Nello studio della termodinamica spesso capita che le variazioni di energia
diversa dall’energia interna sono nulle o trascurabili e in tal caso la
variazione di energia interna si identifica con la somma (algebrica) del lavoro
e del calore entranti in un corpo, in tal caso si può scrivere:
(4)
U2 – U1 =
Q – L
La (4) rappresenta la forma più utilizzata del primo principio.
Stato fisico di un sistema
Dato un sistema il suo Stato fisico è
assegnato quando definisco tutte le grandezze atte a descrivere integralmente
il sistema stesso. Tale definizione è valida solo in caso di sistemi omogenei,
cioè sistemi che in ogni punto hanno le medesime caratteristiche fisiche, e
quindi le proprietà che li descrivono valgono ovunque.
Energia interna come funzione di stato
In termodinamica una grandezza che dipende da
volume, pressione e temperatura, cioè da quei parametri che caratterizzano le
proprietà macroscopiche di un sistema, indipendentemente dalla sua struttura
locale, viene definita Funzione di Stato. Intuitivamente
funzioni di stato sono quelle variabili il cui valore non dipende dal cammino
effettuato, ma dal punto iniziale e finale.
Il calore Q e il lavoro L non sono funzioni di
stato, perché il loro valore dipende dal cammino percorso. Solamente le
funzioni di stato sono grandezze differenziabili, quindi oggetti come dQ e dL
non sono differenziali esatti; pertanto per indicare l’inesattezza di tali
differenziali si utilizza la seguente notazione ðQ e ðL, che sta ad indicare
piccole variazioni rispettivamente di calore e lavoro.
In base a queste considerazioni vediamo se l’energia
interna è una funzione di stato.
Un sistema caratterizzato da un particolare stato fisico può passare da uno stato iniziale ad uno finale mediante diversi percorsi, non necessariamente per quelli più diretti.

Figura 4 - Possibili cammini
Supponiamo
di avere un gas contenuto in un recipiente dotato di un pistone. Mediante tale
pistone comprimo il gas: il suo volume cala mentre la pressione sale. Tale
sistema si porta da uno stato iniziale, di equilibrio, a quello finale,
mediante infinite trasformazioni, e quindi graficamente mediante diversi
cammini.

Figura 5 - Recipiente dotato di pistone contenente
un gas
Chiamo F la forza applicata sul pistone, z la sua posizione e A l’area sottesa, si ha:
(5)
F = PA
Dove P rappresenta la pressione del gas. Il volume V è dato da:
(6)
V = Az
Ma comprimendo il gas mediante il pistone il volume varia secondo la seguente relazione:
(7)
∆V = A ∆z
quindi il lavoro subito dal gas è:
(8)
L = F∆z
Sostituendo ottengo:
(9)
L = P∆V
Se analizziamo graficamente il processo, il lavoro L è rappresentato
dal percorso rappresentato in figura:

Figura d
- Percorso seguito nella compressione del gas
Quindi un diverso cammino implica un calore e lavoro diversi, ma, in base alle numerose osservazioni compiute, la differenza tra calore Q e lavoro L rimane costante, cioè:
(10)
Q – L = cost
Ciò
significa che la variazione di energia interna del sistema è
una costante di stato, per questo
∆U è
una funzione di stato. Quindi è perfettamente lecito indicare una variazione
infinitesima dell’energia interna del sistema con il simbolo dU.
CONCLUSIONI
Il primo
principio, identificato con il principio di conservazione dell’energia, non
riesce a distinguere tra le sue diverse forme; si dice che esso coglie
l’aspetto quantitativo dell’energia senza coglierne la qualità.
Se, per esempio, si pone
un cubetto di acciaio freddo in un bicchiere di acqua calda, sperimentalmente
si nota che l’acciaio si scalda e l’acqua si raffredda; agli effetti del primo
principio l’acqua cede parte della sua energia interna all’acciaio che,
acquisendola si riscalda; sempre con
riferimento al primo principio poteva però verificarsi che l’acqua si
riscaldasse ulteriormente aumentando la sua energia interna e l’acciaio si
raffreddasse ulteriormente,diminuendo la sua energia interna dello stesso
quantitativo; ogni persona con un minimo di sensibilità fisica sa tuttavia che
questo secondo evento non può verificarsi: questa osservazione ha aperto la
strada al secondo principio della termodinamica.
Esercizi relativi al primo principio della termodinamica
Affronteremo in questa sezione esercizi riguardanti
il primo principio della termodinamica
relativo ai sistemi chiusi. Utilizzeremo in alcuni casi un recipiente
indeformabile e termicamente isolato, in cui non si verifica scambio di calore
con l’esterno, quindi con Q = 0.
Figura 1 – Recipiente termicamente isolato
Esercizio 1
Un recipiente termicamente isolato contiene 100 l di acqua alla temperatura iniziale di 20°C. Il recipiente è dotato di un’elica azionata da un motore della potenza di 0.5 CV; tale motore dissipa energia meccanica per una durata t di 20 minuti.
Determinare la variazione di
energia interna DU e la variazione di
temperatura subita dal recipiente, sapendo che esso ha massa M = 100kg .
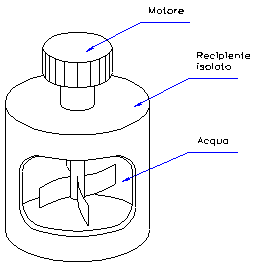
Figura 2 – recipiente termicamente isolato dotato di elica
Svolgimento
Innanzi tutto esprimiamo tutte le grandezze nelle unità di misura del Sistema Internazionale (SI).
P = 0.5 × 736 = 368 W
t = 20 × 60 = 1200 s
Utilizziamo per la
risoluzione il primo principio:
(1)
U2 – U1 = DU = Q – L
Per ipotesi tra il recipiente e l’ambiente non avviene scambio di calore (Q = 0), mentre il lavoro, poiché fatto sul sistema, risulta essere negativo; Quindi si ha:
(2)
DU = - L = - (-Pt) = 368 .1200 = 441600J
Per calcolare la variazione di temperatura subita dal recipiente devo conoscere la capacità termica dell’acqua a volume costante.
Il calore specifico dell’acqua è : 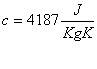
Ora utilizzo tale formula :
(3)
CV = M.Cv
= 100.4187![]() = 418700
= 418700![]()
E ottengo la capacità termica specifica dell’acqua. Ora:
(4)
TF – Ti = DT = ![]() = 1,05 K
= 1,05 K
![]()
Esercizio 2
Un recipiente termicamente
isolato contiene 100 l d’acqua alla temperatura iniziale di 20°C. All’interno
del recipiente vi è un albero azionato da una puleggia aggravata da un peso di
100Kg che, tramite un’elica, dissipa energia meccanica. Nel recipiente vi è
anche una resistenza di 0.2 W che dissipa calore
per effetto Joule.
Attraverso questa resistenza circola una corrente di 6 A, per un periodo t di 5 minuti.
L’effetto dell’energia elettrica deve equivalere a quello dell’energia meccanica prodotta dalla caduta del grave.
In base a ciò determinare il
dislivello DZ da cui deve cadere il grave.

Figura 3 – Recipiente con puleggia e resistenza
Soluzione
I dati trasformati sono i seguenti:
M = 100Kg
t = 5 × 60 = 300 s
Utilizzando ancora una volt il primo principio
ricaviamo:
(1)
DU = Q = R × i 2 × t = 0,2 × 6 2 × 300 = 2160 J
Abbiamo ottenuto questo risultato perché la variazione di energia, dovuta alla resistenza, è data dal solo contributo del calore.
La variazione di energia DU dovuta alla massa che cade:
(2)
DU = - L = + M × g × DZ
quindi:
(3)
DZ = ![]() = 2.20 m
= 2.20 m
Il lavoro è negativo, perché svolto sul sistema, inoltre non c’è scambio di calore poiché stiamo verificando il primo principio sull’universo e non all’interno del sistema.
![]()
Esercizio 3
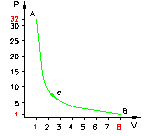
Una massa di gas compie una trasformazione da uno stato iniziale A ad uno stato finale B attraverso diversi stati.
L’espansione da A a B può avvenire attraverso tre
differenti percorsi:
Þ
la
curva a nel grafico rappresenta una trasformazione isobara
(pressione costante) seguita da un’isocora (volume costante);
Þ
la
curva b rappresenta una trasformazione in cui la pressione ed il volume variano
linearmente;
Þ
la
curva c rappresenta una trasformazione adiabatica, vale a dire una
trasformazione lungo la quale non vi è scambio di calore, quindi Q = 0;
La nostra trasformazione adiabatica è del tipo:
(1) p× v![]() = cost
= cost
Determinare calore e lavoro nelle tre trasformazioni.

Figura 4 – Possibili trasformazioni
Svolgimento
I dati trasformati sono i seguenti:
VA = 0,001 m3 , VB =
0,008 m3
PA = 32 × 105 Pa ,PB = 1ּ105 Pa
Calcoliamo il lavoro lungo la trasformazione c:
in questa trasformazione non vi è scambio di calore quindi il primo principio diventa:
(2)
DU = UA – UB
= LC
Sapendo inoltre che il lavoro è uguale all’area sottesa dalla curva c otterremo:
(3) ![]()
Sfruttando i dati iniziali ricaviamo:
(4) ![]()
quindi:
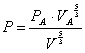
allora risolvendo l’integrale otteniamo che il lavoro vale:
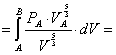
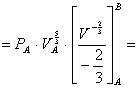
![]()
![]()
![]()
introducendo i valori numerici l’equazione diviene:
![]()
Ora esaminiamo il cammino lungo la curva a: il lavoro è semplicemente l’area sottesa dalla curva.
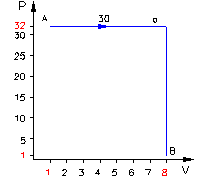
(5) ![]()
Notiamo che il lavoro lungo a è più grande mentre l’energia interna è la stessa.
Sapendo che DU = Q – L otteniamo:
(6) ![]()
Quindi la trasformazione a è migliore della c, poiché il calore ricevuto dall’esterno viene trasformato in lavoro e quindi viene sfruttato.
Esaminiamo ora il cammino lungo la curva b:
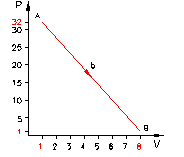
(7) 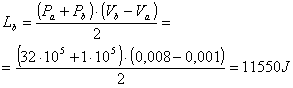
Analogamente a prima otteniamo:
![]()
Quindi si è prodotto meno lavoro poiché si è ricevuto meno calore dall’esterno.
![]()
![]()
![]()
![]()