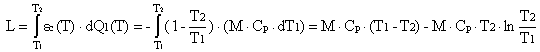ENTALPIA
ED ENTROPIA
ENTALPIA:
L’entalpia è una funzione di stato di un sistema ed esprime la
quantità di energia che esso può scambiare con l'ambiente. Ad esempio, in una
reazione chimica, l'entalpia scambiata dal sistema consiste nel calore
assorbito o rilasciato nel corso della reazione. In un passaggio di stato, come
la trasformazione di una sostanza dalla sua forma liquida a quella gassosa,
l'entalpia del sistema è il calore latente di evaporazione. In un semplice
processo di variazione della temperatura, l'entalpia scambiata dal sistema per
variazioni unitarie di temperatura è data dalla capacità termica a pressione
costante. La definizione formale dell'entalpia è:
(-1-) H = U + pV
dove U rappresenta l'energia interna del
sistema, p la pressione, e V il volume. Essendo H una forma di energia, l'unità di
misura adottata nel Sistema Internazionale è il joule.
Poiché sia U, come p e V dipendono unicamente dallo stato del sistema, anche H dipende unicamente dallo stato; essendo U e V grandezze estensive, anche l’entalpia è una grandezza estensiva; si ha quindi, per un corpo omogeneo:
(-2-)
H = P×h
essendo P il peso del corpo ed h l’entalpia
specifica, la cui unità di misura adottata nel Sistema Internazionale è il
joule su chilogrammo.
Per capire meglio il concetto di entalpia e per tracciare le caratteristiche fondamentali di tale grandezza fisica si consideri il seguente esperimento:
Supponiamo di avere una pentola, dotata di
coperchio, al cui interno vi sia dell’aria alla temperatura di 20°C ed alla pressione di 1 BAR.
Supponiamo ora di porre tale pentola sul fuoco e di bloccare il coperchio, tramite dei blocchi, mantenendo quindi al suo interno un volume costante (PROCESSO ISOCORO). Col passare del tempo il gas aumenterà di temperatura e, quindi, vi sarà un conseguente aumento di pressione:
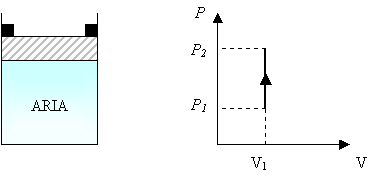
-Figura 1-
Per il primo principio, essendo il lavoro esterno nullo, si avrà:
(-3-)
U2
– U1 = Q
quindi
(-4-) MCv(T2 - T1) = Q
dove M è la massa del gas e Cv la
capacità termica specifica a volume costante.
Quindi
in una trasformazione a volume costante, detta ISOCORA, il calore scambiato è uguale alla variazione di
energia interna.
Supponiamo adesso di togliere i blocchi, cioè lasciamo il sistema libero di espandersi. A differenza di prima, la trasformazione si evolverà a pressione costante (PROCESSO ISOBARO),ma vi sarà un aumento di volume da parte del gas, e un conseguente lavoro esterno dato dall’area sottesa dalla linea di trasformazione:
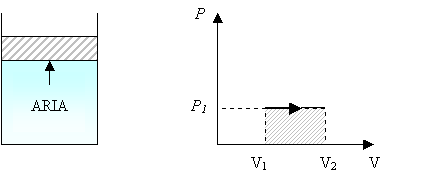
-Figura 2-
(-5-) L = p(V2 – V1)
Dal
Primo Principio
si ha il seguente bilancio energetico:
(-6-) U2 – U1
= Q – L = Q – p(V2 – V1)
ed essendo, a pressione costante, la quantità di
calore fornita per andare da T1 a T2 pari a:
(-7-)
Q = MCp(T2
– T1)
dove M è la massa del gas e Cp la
capacità termica a pressione costante.
Uguagliando la (-6-) e la (-7-) otteniamo:
(-8-) U2 + p2V2 – (U1 +
p1V1) = MCp(T2 – T1)
Dalla definizione di entalpia, segue che:
(-9-) H2 – H1 = MCp(T2 – T1)
Quindi in una trasformazione a pressione costante, detta ISOBARA, il calore scambiato è uguale alla variazione di entalpia.
Dall’esperimento fatto si deduce che l’energia interna e l’entalpia sono grandezze simmetriche che si utilizzano, rispettivamente, in caso di volume o pressione costante. Inoltre, grazie all’entalpia, è possibile riscrivere il Primo Principio della termodinamica in forma entalpica:
(-10-) du =
dq – dl Þ du = dq – pdv Þ dq = du – pdv
scrivendo l’espressione dell’entalpia in forma differenziale osserviamo che:
(-11-) dh = du + pdv + vdp
sostituendo
ora la (-10-) nella (-11-) otteniamo:
(-12-)
dh = dq + vdp
Quest’espressione
è utile per il calcolo diretto dell’entalpia conoscendo il calore specifico a
pressione costante CP:
infatti, se una trasformazione è isobara il termine vdp si annulla e rimane dh =
dq. Sapendo che il calore specifico a pressione costante vale:
(-13-) Cp ![]()
segue
che, noto CP, si può
ottenere h integrando l’espressione
(-13-):
(-14-) 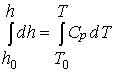 Þ h =
Þ h = ![]() (T - T0
)
(T - T0
)
dove ![]() indica il calore
specifico medio a pressione
costante.
indica il calore
specifico medio a pressione
costante.
ENTROPIA:
Trattazione concettuale
dell’entropia
L’energia di un sistema è
una proprietà che possiamo utilizzare per decidere se un determinato stato è
raggiungibile o meno. Ma c’è un modo per sapere se un determinato stato è
raggiungibile spontaneamente? Ci dovrebbe essere una proprietà che sia in grado
di comportarsi come un indicatore di una trasformazione naturale e spontanea,
che possa avvenire senza interventi esterni. Una tale proprietà esiste ed è
l’entropia. L’entropia può essere definita in questo modo: consideriamo due
stati particolari di un sistema isolato, che chiameremo stato A e stato B; se
l’entropia è maggiore nello stato B allora questo può essere raggiunto
spontaneamente dallo stato A del sistema. Viceversa, lo stato A non può essere
raggiunto spontaneamente dallo stato B del sistema, cioè non lo possiamo
raggiungere senza rompere l’isolamento del sistema. L’entropia di un sistema
quindi aumenta ogni qual volta che avviene una trasformazione spontanea, mentre
può diminuire nel caso di una trasformazione non spontanea, che però, proprio
perché non spontanea, rompe l’isolamento del sistema. Se consideriamo l’intero
Universo, dove non possono avvenire trasformazioni non spontanee (altrimenti
dovremmo ammettere un altro sistema esterno all’Universo, ma noi con il termine
Universo intendiamo “tutto ciò che esiste”), l’entropia non diminuisce mai, ma
aumenta sempre. Anche il concetto di entropia quindi afferma l’asimmetria della
natura, e può quindi essere visto come un altro aspetto del Secondo Principio
della Termodinamica. Esso può essere enunciato in questo modo:
Qualunque trasformazione
spontanea è accompagnata da un aumento
dell’ entropia
dell’Universo.
Questo enunciato del Secondo
Principio è talvolta chiamato anche “ Principio dell’entropia”.
Trattazione
rigorosa dell’entropia
Prima di entrare
nell’argomento è utile dare la definizione di alcuni termini che ci aiuteranno
nel approfondire meglio il concetto:
§
EQUILIBRIO:
un sistema si dice in equilibrio quando i valori dei parametri che definiscono
il suo stato non variano nel tempo, a meno che non cambi l’iterazione con
l’ambiente esterno;
§
INTERNAMENTE
INVERTIBILE: un sistema si dice internamente invertibile o reversibile se può
ritornare lungo la stessa linea di trasformazione nello stato iniziale i
senza che si verifichino variazioni nello stato dell’ambiente circostante;
§
INTERNAMENTE
NON INVERTIBILE: un sistema si dice internamente non invertibile o
irreversibile se passa da uno stato iniziale i a uno stato finale f,
ma non può più effettuare il processo inverso.
Tutti i processi di
trasformazione del lavoro in calore sono spontanei, mentre le trasformazioni da
calore in lavoro avvengono solo se accompagnate da altri processi.
Consideriamo il ciclo 1C2D1 (Figura 3)
una trasformazione ciclica internamente invertibile subita da un corpo il cui
stato fisico è determinato dalle variabili P e V. Si scomponga il ciclo in un
numero infinito di cicli infinitesimi mediante una serie di adiabatiche.
Sia abdg uno di tali cicli. Siano ab
e cd tratti infinitesimi di isotermiche (compresi tra le adiabatiche
ag e bd) corrispondenti
rispettivamente a temperature comprese tra i valori della temperatura nei punti
a e b e nei punti g e d.
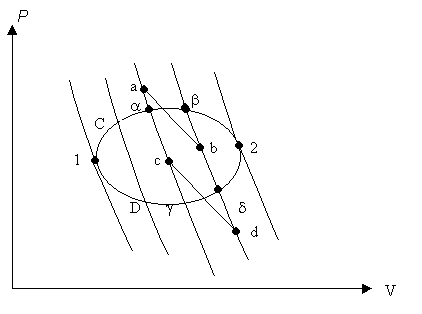
-Figura 3-
Il
ciclo abdca è un ciclo di Carnot, quindi, il calore dQ’ dato lungo il tratto
infinitesimo di isotermica ab a temperatura T’ è uguale, a meno di un
infinitesimo di secondo ordine, al calore dQ1 dato lungo la ab; così pure il calore dQ’’ sottratto lungo la isotermica dc
a temperatura T’’ è uguale, sempre a meno di un infinitesimo di
secondo ordine, al calore dQ2 tolto lungo dg. Per il ciclo abdga si ha quindi:
(-15-) ![]() =
= ![]()
Poiché
la stessa relazione sussiste per tutti gli altri cicli infinitesimi nei quali
si può scomporre il ciclo dato con una serie di adiabatiche, si avrà (indicando
genericamente con dQ la quantità di calore data
o tolta lungo un tratto infinitesimo del ciclo nel quale la temperatura è T)
che:
(-16-) 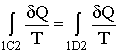
Si può quindi concludere che
per una trasformazione internamente invertibile l’integrale definito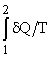 dipende unicamente dallo stato iniziale e finale; cioè,
è indipendente dalla linea di trasformazione, purché questa sia internamente
invertibile.
dipende unicamente dallo stato iniziale e finale; cioè,
è indipendente dalla linea di trasformazione, purché questa sia internamente
invertibile.
Tale
integrale è quindi uguale alla variazione subita da una grandezza funzione di
stato, che viene detta entropia, e che verrà indicata col simbolo
S.
Se gli
stati 1 e 2 coincidono, se si tratta cioè di una trasformazione ciclica, tale
integrale si annulla, quindi si ha, per un ciclo internamente invertibile:
(-17-) ![]() = 0
= 0
Come si è visto, la
variazione di entropia subita da un corpo nel passare da uno stato ad un altro
stato dipende unicamente dallo stato iniziale e dallo stato finale, è
indipendente dalla curva di trasformazione. In altre parole: l’entropia, come l’energia
interna e l’entalpia, è funzione dello stato fisico, cioè ![]() è un differenziale
esatto; si era visto precedentemente che dQ non è un differenziale
esatto; si è ora constatato, e lo dimostreremo in seguito, che
è un differenziale
esatto; si era visto precedentemente che dQ non è un differenziale
esatto; si è ora constatato, e lo dimostreremo in seguito, che ![]() è un fattore integrante di dQ.
è un fattore integrante di dQ.
E’
importante rilevare che l’integrale ![]() definisce e permette
di calcolare le variazioni di entropia,non i valori assoluti. Per fare in modo
che per un dato corpo ad ogni stato corrisponda un valore determinato
dell’entropia si fa una convenzione analoga a quella fatta a suo tempo per
l’energia interna: si ammette cioè che in corrispondenza ad uno stato
determinato l’entropia valga zero. Bisogna tener presente che questa è una
semplice convenzione, che è possibile precisamente perché il suddetto integrale
definisce soltanto le variazioni (e non i valori assoluti) della entropia.
definisce e permette
di calcolare le variazioni di entropia,non i valori assoluti. Per fare in modo
che per un dato corpo ad ogni stato corrisponda un valore determinato
dell’entropia si fa una convenzione analoga a quella fatta a suo tempo per
l’energia interna: si ammette cioè che in corrispondenza ad uno stato
determinato l’entropia valga zero. Bisogna tener presente che questa è una
semplice convenzione, che è possibile precisamente perché il suddetto integrale
definisce soltanto le variazioni (e non i valori assoluti) della entropia.
Fatta questa precisazione,
si constata che se un corpo passa dallo stato 1 allo stato 2 subendo una
trasformazione non invertibile, non è vero che l’integrale ![]() , calcolato per la trasformazione realmente avvenuta, dipenda
soltanto dagli stati iniziali e finali (anzi il più delle volte tale integrale
non ha senso perché nel medesimo istante la T varierà da punto a punto nella
massa del corpo). Però anche in questo caso si può parlare di variazione di
entropia subita dal corpo, che risulta ancora espressa dall’integrale
, calcolato per la trasformazione realmente avvenuta, dipenda
soltanto dagli stati iniziali e finali (anzi il più delle volte tale integrale
non ha senso perché nel medesimo istante la T varierà da punto a punto nella
massa del corpo). Però anche in questo caso si può parlare di variazione di
entropia subita dal corpo, che risulta ancora espressa dall’integrale ![]() intendendosi però
l’integrale calcolato non per la trasformazione realmente avvenuta, ma per una
trasformazione qualunque internamente invertibile, nella quale il corpo passi
dal medesimo stato 1 al medesimo stato 2.
intendendosi però
l’integrale calcolato non per la trasformazione realmente avvenuta, ma per una
trasformazione qualunque internamente invertibile, nella quale il corpo passi
dal medesimo stato 1 al medesimo stato 2.
Uguaglianza di Clausius
L’uguaglianza di Clausius è di grande importanza perché permette di
affermare che la quantità ![]() è un differenziale
esatto e quindi che l’integrale
è un differenziale
esatto e quindi che l’integrale ![]() calcolato per una
trasformazione invertibile dipende soltanto dagli stati iniziali e finali.
Vediamo la dimostrazione di quanto detto.
calcolato per una
trasformazione invertibile dipende soltanto dagli stati iniziali e finali.
Vediamo la dimostrazione di quanto detto.
Si consideri un corpo (o un
sistema di corpi) A qualunque,che subisce una serie di trasformazioni alla fine
delle quali ritorna allo stato iniziale.
Durante la trasformazione, A scambia con le sorgenti di calore 1, 2, …, n
, aventi temperature T1, T2, …, Tn
(misurate nella scala termodinamica), le quantità di calore Q1, Q2,
…, Qn , intese positive se date al corpo e negative se tolte
(la dimostrazione risulta più chiara se si esamina la figura 4, nella quale si
è posto che A riceva calore dalle sorgenti 1 e 2, e ceda calore alle sorgenti 3
e 4).
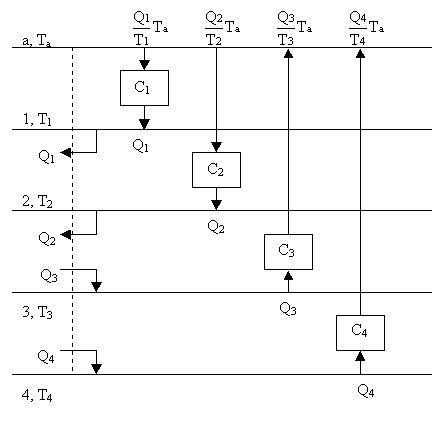
-Figura 4-
Poiché alla fine della trasformazione A è ritornato
nello stato iniziale, si ha che l’unico risultato è che si siano tolte alle
sorgenti le quantità di calore Q1, Q2, …, Qn
(positive o negative), e si è prodotta una certa quantità di lavoro LA
(positiva o negativa).
Per il Primo Principio si
ha:
(-18-) Q1
+ Q2 + … + Qn = LA
Si abbia una sorgente
ausiliaria di calore a, avente una temperatura Ta, che in linea
di principio potrebbe essere qualunque, ma che per comodità di esposizione si
suppone maggiore delle temperature delle sorgenti 1, 2, …, n (figura 4).
Valendosi di questa sorgente e di n macchine di Carnot C1, C2,
…, Cn, nelle quali un corpo intermediario scambia calore con
la sorgente ausiliaria a e, rispettivamente, con le sorgenti 1, 2, …, n,
si può riportare con una serie di trasformazioni invertibili tutte le sorgenti
1, 2, …, n, nello stato iniziale. Considerata, infatti, una qualunque
delle sorgenti 1, 2, …, n, che si indicherà con i, e dalla quale
A aveva sottratto il calore Qi supposto, per fissare le idee,
positivo, si può immaginare che la macchina di Carnot Ci
percorrendo un ciclo diretto, versi il calore Qi alla
sorgente i e sottragga il calore Q’i alla
sorgente ausiliaria. Se invece Qi è negativo (cioè il corpo A
ha versato calore alla sorgente i) si deve supporre che la macchina di
Carnot Ci compia un ciclo in senso inverso
(funzionando cioè come macchina frigorifera), nel quale sottrae il calore ![]() ( inteso in valore
assoluto) alla i e versa una certa quantità di calore alla sorgente
ausiliaria. In entrambi i casi, dalla relazione esprimente il rendimento del
ciclo di Carnot, si ottiene che:
( inteso in valore
assoluto) alla i e versa una certa quantità di calore alla sorgente
ausiliaria. In entrambi i casi, dalla relazione esprimente il rendimento del
ciclo di Carnot, si ottiene che:
(-19-) ![]() =
= ![]()
Questa relazione vale, non
soltanto in valore assoluto, ma anche tenendo conto dei segnali delle Qi
ove si faccia la convenzione di considerare le quantità di calore Qi
come positive se sono sottratte alla
sorgente a, e come negative nel caso contrario. Dopo che con le n
macchine di Carnot si sono in tale modo compensate le quantità di calore Q1,
Q2, …, Qn scambiate tra le sorgenti 1, 2, …, n
e A, si ha che non soltanto A, ma anche tutte le sorgenti 1, 2, …, n sono
ritornate allo stato iniziale. L’unico risultato residuo è che si è sottratta alla
sorgente ausiliaria la quantità di calore Q’ = ![]() e si è prodotto
una certa quantità di lavoro L’, somma algebrica del lavoro LA
compiuto nel ciclo percorso dal sistema A, e del lavoro totale LC
compiuto dalle macchine di Carnot C1, C2, …, Cn.
Per il Primo Principio si ha Q’
= L’, quindi, tenendo conto delle (-19-) segue che:
e si è prodotto
una certa quantità di lavoro L’, somma algebrica del lavoro LA
compiuto nel ciclo percorso dal sistema A, e del lavoro totale LC
compiuto dalle macchine di Carnot C1, C2, …, Cn.
Per il Primo Principio si ha Q’
= L’, quindi, tenendo conto delle (-19-) segue che:
(-20-) L’
= Q’ = ![]() = Ta
= Ta
![]()
Il lavoro L’, e
quindi il calore Q’, non possono essere maggiori di zero, infatti,
poiché alla fine delle trasformazioni considerate il sistema costituito da A,
dalle sorgenti 1, 2, …, n e dai corpi operanti nelle macchine di Carnot
C1, C2, …, Cn è ritornato nelle
condizioni iniziali, se L’ e Q’ fossero positivi, si
sarebbe realizzato un complesso di trasformazioni il cui unico risultato
sarebbe stato la trasformazione in lavoro della quantità di calore Q’
tolta alla sorgente ausiliaria, in opposizione al Secondo Principio. Quindi si
ha:
(-21-) L’
= Q’ = Ta ![]()
cioè, poiché
Ta è positiva:
(-22-) ![]()
![]() 0
0
Tutto questo vale sia nella
ipotesi che il ciclo percorso dal sistema A sia internamente invertibile, sia
nell’ipotesi contraria.
Analizziamo i due singoli
casi:
·
Si
supponga che tale ciclo non sia internamente invertibile. In tale caso la
trasformazione subita dal sistema termicamente isolato costituito da A, dai
corpi operanti nelle macchine di Carnot C1, C2, …, Cn
e dalle sorgenti di calore 1, 2, …, n ed a ha subito una
trasformazione che non è completamente invertibile, alla fine della quale non
può quindi essere ritornato nello stato iniziale. Perciò in questo caso Q’
ed L’ non possono essere uguali a zero. Quindi si ha:
(-23-) ![]() < 0
< 0
Si noti che in questa relazione le Ti sono le
temperature delle sorgenti
con le quali A scambia calore, e non le temperature di A, che d’altra
parte non sono definite perché,
essendo per ipotesi la trasformazione
subita da A non invertibile, si avrà che istante per istante la
temperatura
del corpo sarà in generale diversa da punto a punto.
·
Si
supponga che tale ciclo percorso da A sia internamente invertibile e che quindi
la sua temperatura sia in ogni istante uniforme. In questo caso, si può
supporre che, quando una generica sorgente i scambia la quantità di
calore Qi con A, le
temperature della sorgente e del corpo siano uguali. In questa ipotesi il
sistema termicamente isolato ha subito una trasformazione completamente
invertibile. Ne segue per il Secondo Principio, che Q’ ed L’
non possono essere minori di zero. Infatti, se nella trasformazione considerata
Q’ ed L’ fossero negativi, cioè l’unico risultato fosse
stato una trasformazione di una certa quantità di lavoro ![]() in calore
in calore![]() versato alla sorgente a, in opposizione al postulato
di Kelvin. Quindi nel caso di cicli internamente invertibili si ha:
versato alla sorgente a, in opposizione al postulato
di Kelvin. Quindi nel caso di cicli internamente invertibili si ha:
(-24-) ![]() = 0 UGUAGLIANZA DI CLAUSIUS
= 0 UGUAGLIANZA DI CLAUSIUS
Si era supposto finora che
il corpo A scambiasse calore con n sorgenti. Se il numero delle sorgenti
diviene infinito, le sommatorie che compaiono nelle relazioni precedenti devono
essere sostituite da integrali estesi alla trasformazione ciclica subita da A.
Indicando con ![]() l’integrale esteso ad un ciclo, si ha quindi, se il ciclo non
è internamente invertibile:
l’integrale esteso ad un ciclo, si ha quindi, se il ciclo non
è internamente invertibile:
(-25-) ![]() < 0
< 0
e, se il ciclo è internamente invertibile:
(-26-) ![]() = 0 INTEGRALE DI CLAUSIUS
= 0 INTEGRALE DI CLAUSIUS
In entrambi i casi dQ è la quantità di calore infinitesima
scambiata da A con una sorgente generica avente temperatura T.
Dalla (-26-), segue che in una trasformazione
internamente invertibile 1 ® 2 , l’integrale 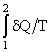 dipende soltanto
dagli stati estremi 1 e 2, cioè è indipendente dagli stati intermedi per i
quali è passato il corpo A.
dipende soltanto
dagli stati estremi 1 e 2, cioè è indipendente dagli stati intermedi per i
quali è passato il corpo A.
Si
considerino infatti due trasformazioni entrambe internamente invertibili 1m2
ed 1n2, che hanno comune gli stati estremi 1 e 2. La trasformazione 1m2n1
è una trasformazione ciclica internamente invertibile, per la quale vale l’integrale
di Clausius. Si ha quindi, spezzando l’integrale ![]() in due, relativi alle
trasformazioni 1m2 e 2n1:
in due, relativi alle
trasformazioni 1m2 e 2n1:
(-27-) 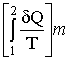 +
+ 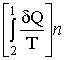 = 0
= 0
cioè:
(-28-) 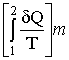 =
= 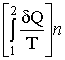
che dimostra l’asserto.
Si scelga ora ad arbitrio uno stato 0
di equilibrio del sistema A (stato standard), e
si indichi con
f uno stato, pure di equilibrio, che può essere qualunque, cioè
variabile.
Si ha allora
che 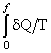 (esteso naturalmente
ad una trasformazione invertibile) per
(esteso naturalmente
ad una trasformazione invertibile) per
un dato stato
0 dipende esclusivamente dai parametri che individuano lo stato f. Il
valore di tale
integrale viene detto entropia del sistema A nello stato
f e verrà
indicato col
simbolo Sf. In particolare, per due stati 1 e 2 di
equilibrio si avrà:
(-29-) ![]() = S1
= S1 ![]() = S2
= S2
E’ ovvio che nello stato 0
l’entropia è uguale a zero per convenzione.
Si consideri ora una
trasformazione invertibile che conduce dallo stato standard 0 allo stato 2
passando per lo stato 1. Si avrà allora:
(-30-) ![]() =
= ![]() +
+ ![]()
cioè per le (-29-):
(-31-) ![]() = S2 – S1
= S2 – S1
Si vede cioè che, mentre il
valore che assume l’entropia in uno stato fissato f dipende dallo stato
0 scelto come standard, la variazione di entropia tra due stati dipende
soltanto da questi, cioè l’entropia in uno stato risulta determinata a meno di
una costante additiva arbitraria che dipende dallo stato 0 scelto come normale.
Una proprietà importante è
che la variazione di entropia di un sistema è uguale alla somma algebrica delle
variazioni di entropia subite dalle varie parti in cui si può immaginare
scomposto il sistema. Si ha infatti, in una trasformazione infinitesima:
(-32-) dQ = dU
+ p dV
essendo U l’energia interna e V il
volume del sistema. Il volume gode ovviamente della proprietà additiva, cioè il
volume del sistema è la somma dei volumi delle parti in cui si può immaginare
scomposto il sistema. La medesima proprietà sussiste per l’energia interna. Ne
segue, poiché l’entropia Sf in un generico stato f è
espressa da
(-33-) ![]() =
= 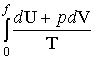
![]()
che l’entropia di un sistema è la somma delle
entropie delle varie parti in cui si può immaginare scomposto il sistema.
In conseguenza l’entropia di
un corpo omogeneo in un dato stato, determinato ad esempio dalle variabili p,
v , T, è proporzionale alla massa o al peso misurato con una bilancia a
leva. Cioè si ha per un corpo omogeneo:
(-34-) S = P × s
dove P è il peso o la massa del corpo, ed s
l’entropia specifica, riferita all’unità di peso o di massa,
che dipende, a meno di una costante additiva, esclusivamente dai parametri che
individuano lo stato del corpo, ma è indipendente dalla sua massa.
Teorema dell’aumento
dell’entropia
Le considerazioni precedenti
definiscono l’entropia in uno stato generico f a condizione che sia
possibile immaginare una trasformazione internamente invertibile, cioè una
successione di stati di equilibrio, che conduca dallo stato 0 allo stato f.
Questa condizione è in generale
soddisfatta se f è uno stato di equilibrio, ma non può ovviamente essere
valida nel caso contrario.
Anche per stati di non
equilibrio si può sovente definire l’entropia se si ammette come postulato che
la proprietà di additività dell’entropia, che è stata dimostrata per gli stati
di equilibrio, valga anche per gli stati di non equilibrio.
Infatti spesso un corpo non
in equilibrio può immaginarsi suddiviso in un numero, finito o infinito, di
parti, ciascuna delle quali, considerata da sola, cioè supposta divisa dal
resto del sistema mediante diaframmi rigidi ed isolanti per il calore, sarebbe
in equilibrio.Per ciascuna di queste parti l’entropia è definita, quindi essa
risulta definita per tutto il sistema se si ammette come postulato che
l’entropia del sistema sia uguale alla somma delle entropie delle parti in cui
può essere suddiviso, pertanto queste considerazioni valgono soltanto se si
trascurano i fenomeni di superficie, perché trascurano il fatto che, a rigore,
l’introduzione dei diaframmi indicati, altera lo stato del sistema.
Si consideri un sistema di
corpi che subisce una trasformazione internamente non invertibile 1m2
dove gli stati estremi 1 e 2 sono in equilibrio. Sia 1n2 una
trasformazione internamente invertibile che conduce da 1 a 2, cioè una
successione continua di stati di
equilibrio che ha per estremi i medesimi stati 1 e 2. Il ciclo 1m2n1
è internamente non invertibile, perché di esso fa parte la trasformazione non
invertibile 1m2. Quindi per tale ciclo si ha ![]() < 0, cioè spezzando
l’integrale:
< 0, cioè spezzando
l’integrale:
(-35-) 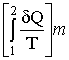 +
+ 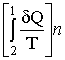 < 0
< 0
cioè:
(-36-) 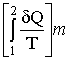 <
< 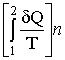
Quindi, poiché
è:
(-37-) S2 - S1 = 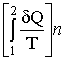
risulta:
(-38-) S2 - S1 > 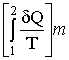
Si supponga che il sistema sia termicamente isolato. In
questo caso è dQ = 0, e quindi:
(-39-) S2 – S1
> 0
Se la trasformazione del
sistema termicamente isolato fosse invertibile, si avrebbe invece, come risulta
dalla (-31-):
(-40-) S2 – S1
= 0
Si può quindi concludere
che:
L entropia di un sistema
termicamente isolato aumenta nelle trasformazioni non invertibili e resta invariata nel caso limite di trasformazioni
invertibili.
Ne segue quindi che, nelle
trasformazioni adiabatiche invertibili, l’entropia resta costante, vale a dire
che tali trasformazioni sono isoentropiche. Su questo teorema sono basate le
ricerche delle condizioni di equilibrio; infatti, se un sistema termicamente
isolato si trova in condizioni tali che qualunque trasformazione virtuale
supposta avvenire nel sistema conduce ad una diminuzione dell’entropia, allora
dal teorema dimostrato si ha che tali trasformazioni non possono avvenire e che
quindi il sistema è in equilibrio.
Nel
definire le trasformazioni invertibili e non invertibili di sistemi
termicamente isolati, ci si era riferiti unicamente agli stati iniziale e
finale. Ciò è ben chiarito dal teorema appena dimostrato, dal quale risulta che
se si considera una trasformazione 1®2 di un sistema termicamente
isolato si hanno queste due alternative:
·
S2
- S1 > 0 Allora
non soltanto la trasformazione considerata, ma anche qualunque altra
trasformazione che conduca dal medesimo stato 1 al medesimo stato 2 è non
invertibile;
·
S2
- S1 = 0 Allora non soltanto la
trasformazione considerata, ma anche qualunque altra trasformazione che conduca
dal medesimo stato 1 al medesimo stato 2 è invertibile.
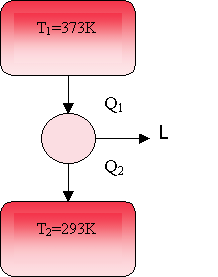
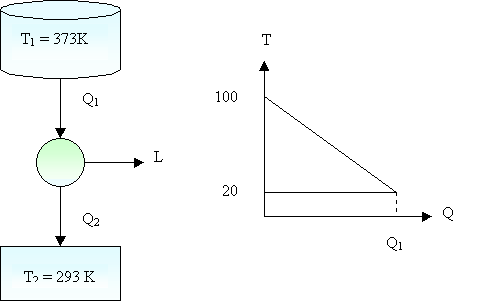
ESERCIZI SUL SECONDO PRINCIPIO
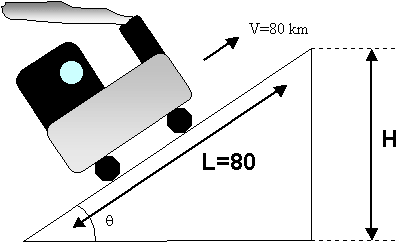
Esercizio 1
Una locomotiva viaggia, per 80 km, lungo un
piano inclinato con velocità di traslazione pari a 80 km/h. Inizialmente ha una
massa pari a 100 tonn, ma il consumo orario di combustibile della caldaia è di
una tonnellata l’ora. Sapendo che la temperatura della caldaia, T1, è di 100°C,
la temperatura dell’ambiente esterno, T2, è di 20°C, che il rendimento
termodinamico, è pari a 0.25 e infine il potere calorifico della macchina, Pci,
vale 14000BTU/lb, si calcoli l’inclinazione del piano che la locomotiva
percorre.
N.B.: BTU = British
thermal unit è l’equivalente anglosassone della caloria, cioè la quantità
di calore che bisogna fornire a una libbra di acqua per innalzare la sua
temperatura di un Farad.