IL PRIMO PRINCIPIO DELLA TERMODINAMICA
Introduzione
La
formulazione del concetto di energia, insieme con la formalizzazione del suo
principio di conservazione, fu uno dei maggiori successi della scienza del XIX
secolo. Fin da quando la dinamica di Newton si era imposta, infatti, il ruolo
centrale ed unificante apparteneva al concetto di forza; anzi, nel 1849 quello
stesso William Thomson, che sarebbe diventato da Lord Kelvin uno dei fondatori
della termodinamica, ancora sosteneva che la fisica fosse la scienza delle
forze.
D'altro
canto alcuni principi di conservazione erano già noti, ma mancavano di
generalità perché li si potesse considerare fondamentali: pensiamo alla
Meccanica ed al classico esempio del pendolo.
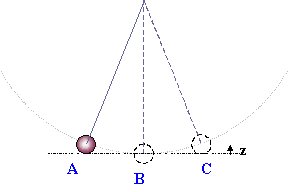
Fig.1 - Pendolo
Se
spostiamo la pallina dalla posizione di equilibrio osserviamo che essa tende a
tornarvi, acquistando velocità, e ad oltrepassarla per risalire dalla parte
opposta alla stessa quota z, iniziando così un moto oscillatorio.
Applicando
schemi "moderni", analizzare questo esperimento è semplice:
assegniamo alla pallina nei punti A e C una certa quantità di energia
potenziale che verso B si trasforma totalmente in energia
cinetica; osserviamo che in condizioni ideali questo trasferimento
proseguirebbe indefinitamente e generalizziamo parlando di conservazione dell'energia meccanica.
Nel XIX secolo la stesso fenomeno sarebbe stato descritto in termini di "forza
viva", ma la differenza non è solo formale, bensì sostanziale: che fine fa infatti la
forza viva quando, a causa degli attriti, il pendolo si ferma? Solo in
un'ottica di bilancio energetico è possibile rispondere che il lavoro
della forza di gravità si converte in calore per l'attrito!
Lo studio
dei fenomeni termici, tuttavia, sin dal XVII secolo si basava sul postulato
dell'esistenza di un fluido imponderabile, il "calorico", in
grado di trasferirsi dai corpi più caldi a quelli più freddi. Si dovette
attendere il 1798 perché Benjamin Thomson, conte Rumford, documentasse un
aumento di temperatura dovuto al trasferimento di energia meccanica, e non di
strani fluidi, sulla base di osservazioni compiute facendo ruotare una trivella
sul fondo di un tubo da cannone. Nel 1849, infine, James Prescott Joule rese
pubblico il celebre "Sull'equivalente meccanico del calore", dove da
accurate esperienze stabilì la diretta proporzionalità tra la "forza
viva" spesa ed il calore prodotto per attrito. Quell'opera, che oggi viene
semplicemente ricordata per la determinazione sperimentale del fattore di
conversione tra due unità di misura, gode d'importanza storica proprio in
quanto verifica empirica dell'equivalenza sostanziale del calore al lavoro come
due modalità di scambio energetico.
A questo
punto fu dunque possibile per i fisici del XIX secolo generalizzare il principio
di conservazione dell'energia e
riconoscere alla stessa il ruolo centrale che merita, mentre noi possiamo
iniziare ad approfondire la lezione.
Lavoro, Energia, Calore
Partiamo
col definire meglio alcune delle grandezze che abbiamo già introdotto.
In
Meccanica il lavoro elementare compiuto da una forza agente su una
particella in moto, fig.2, è istante per istante il prodotto scalare tra la
forza e lo spostamento infinitesimo della particella.
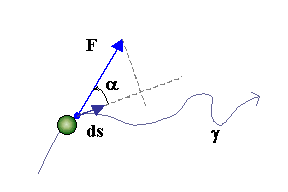
Fig.2 - Definizione di lavoro
Tradotto
in formula:
![]() (1)
(1)
Per ottenere il lavoro eseguito durante uno
spostamento finito, basta integrare la (1) lungo la traiettoria dal punto
iniziale a quello finale:
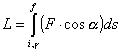 (2)
(2)
Osserviamo che l'integrando altri non è che
la componente della forza tangenziale alla direzione di moto, quindi in caso di
forza costante e perfettamente tangente la (2) si riduce a:
![]() (3)
(3)
L'unità di misura del lavoro è appunto quella
di una forza moltiplicata per quella di una lunghezza, e nel Sistema
Internazionale è il Joule.
Si chiama invece potenza il lavoro prodotto
per unità di tempo,
![]() (4)
(4)
e, se oltre alla forza è costante e parallela
ad essa anche la velocità alla quale si muove la nostra particella, si può
esprimere semplicemente:
![]() (5)
(5)
Le dimensioni della potenza sono infatti
quelle di una forza moltiplicata per una velocità; nel S.I. si misura in Watt.
Molto più vasto rispetto a quello di lavoro è
il concetto di energia; come già preannunciato il primo non è che una forma
della seconda, sebbene la classica definizione che se ne dà sia: "energia
è la capacità di produrre lavoro" o meglio, secondo Ostwald, "energia
è lavoro o tutto ciò che può essere prodotto da o convertito in lavoro".
Queste formule, comunque, non hanno grande utilità operativa, ma cercano solo
di mostrare l'esistenza oggettiva di un'entità, altrimenti un po' astratta, che
può essere acquistata o spesa sotto la forma tangibile di lavoro;
nell'effettiva descrizione dei fenomeni fisici, invece, si definiscono e si
utilizzano particolari tipi di energia.
In Meccanica, ad esempio, la quantità
![]() (6)
(6)
è l'energia cinetica di una
particella in moto rispetto all'osservatore, mentre
![]() (7)
(7)
è l'energia potenziale che la
stessa possiede quando si trova ad una certa quota, rispetto al livello di
riferimento, nel campo conservativo della gravità terrestre. La somma di queste
due prende il nome di energia meccanica ed è la costante nel
movimento del pendolo ideale di fig.1.
Esistono
diverse altre forme, acustica, luminosa, elastica,
nucleare…,
molte delle quali correlate tra loro: l'energia chimica, ad esempio, ha origine da
variazioni di energia atomica, la quale è a sua volta una combinazione di energia
cinetica ed elettromagnetica degli elettroni di
legame…
C'è poi
una forma d'energia in cui tutte le suddette possono facilmente convertire, ma
dalla quale è più difficile effettuare la trasformazione inversa: è il calore,
che per ciò ha un valore economico minore.
Il primo
principio della termodinamica, tuttavia, non si occupa di tali considerazioni
qualitative; esso affronta i problemi di scambio energetico in un'ottica di
bilancio e dal suo punto di vista non esistono energie "di serie B":
la realtà fondamentale è che in qualunque processo l'energia totale in gioco
rimane la stessa. Inoltre ciò vale indipendentemente da come la si misura,
sebbene il valore numerico possa
dipendere dal sistema di riferimento scelto.
Il
postulato di conservazione infatti afferma: l'energia non può essere creata o distrutta, ma può
solo essere convertita in un'altra forma.
A metà del
XIX questa legge ha inglobato quella di conservazione del calore, 60 anni dopo,
come conseguenza della teoria della relatività, ha fagocitato quella di
conservazione della massa, e ora, per usare le parole di Einstein, "domina
il campo da sola". Essa, per quanto ne sappiamo, ha validità del tutto
generale e non è mai stato osservato alcun fenomeno che la violi (è, appunto,
un principio); discende infatti dall'invarianza delle leggi fisiche rispetto
alle traslazioni temporali, che è legata ad una semplice proprietà di simmetria
del tempo: l'omogeneità.
Sistema Termodinamico: definizioni
Stabilita
l'importanza concettuale del primo principio come espressione di una
fondamentale legge di conservazione, per poterlo applicare dobbiamo definire
l'oggetto dei nostri studi.
Col
termine di sistema
termodinamico s'intende una determinata porzione di spazio delimitata
da una superficie, reale o apparente, detta pelle, che racchiude una o più sostanze
chimicamente definite.
Tutto ciò
che si trova al di fuori di tale confine è l'ambiente o contorno,
mentre la loro unione, ossia il sistema più ampio ed onnicomprensivo possibile,
prende il nome di universo.
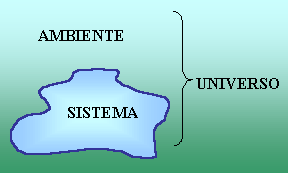
Fig.3 - Definizione di sistema termodinamico
Il sistema
può interagire coll'ambiente mediante scambi di materia e/o energia: per quanto
concerne i primi, se essi sono impediti da una pelle impermeabile in senso
idraulico, il sistema si dice chiuso; viceversa se sono presenti sezioni
d'ingresso e uscita, chiamate luci, il sistema si definisce aperto.
Per quanto
riguarda gli scambi energetici, tralasciando il caso poco interessante di sistema
isolato
nel quale essi sono impediti, si distinguono fondamentalmente due casi: quando
l'interazione è attribuibile ad una forza, di varia natura, che sposta nel
tempo il suo punto d'applicazione, la quantità di energia meccanica scambiata
prende il nome di lavoro termodinamico, mentre si chiama calore la quantità di
energia termica trasferita in seguito allo sviluppo di una differenza di
temperatura tra sistema ed ambiente.
Primo Principio della Termodinamica per sistemi chiusi
L'importanza
pratica delle leggi di conservazione risiede nel fatto che permettono di
stabilire correlazioni tra stati successivi nell'evoluzione di un sistema
fisico anche quando non sono noti i dettagli dei cambiamenti caratterizzanti la
trasformazione; il primo principio della termodinamica non fa eccezione.
Consideriamo
come da fig.4 un sistema chiuso che passi, non c'interessa come o in quanto
tempo, da uno stato iniziale, con un certo valore d'energia, ad uno stato
finale con un diverso valore d'energia.
Fig.4 - Sistema chiuso in trasformazione
Supponiamo,
senza perdita di generalità, che l'energia finale sia maggiore di quella
iniziale ed andiamo a stenderne il bilancio.
È ovvio
che, se l'energia non si crea, il fatto che quella finale sia maggiore di
quella iniziale implica che il sistema ne abbia assorbita la differenza
dall'ambiente:
![]() (8)
(8)
Il fatto però che il sistema sia chiuso
esclude il trasporto convettivo, cioè tutte le modalità di trasferimento
energetico che necessitino l'ingresso di materia: niente energia chimica,
niente energia elettrica… Restano insomma due sole forme d'interazione a cui si
possa ricondurre questa energia scambiata: il lavoro ed il calore.

Fig.5 - Convenzione sui segni
Adottando
allora la convenzione sui segni presentata in fig.5, ossia considerando
positivi per il sistema il calore assorbito dall'ambiente ed il lavoro svolto
su di esso, possiamo riscrivere così la (8):
![]() (9)
(9)
L'equazione (9) è il primo principio della termodinamica per
il sistema chiuso.
Significato fisico del
Primo Principio, Energia Interna
La termodinamica studia in effetti le
relazione esistenti tra gli stati fisici estremi di una trasformazione e le
quantità di energia scambiate nel corso della stessa. Il soggetto di tale
studio, tuttavia, è in genere troppo complesso per essere descritto
meccanicamente come sistema di particelle, sebbene sappiamo che le varie
energie in gioco sono imputabili ai moti rototraslatori delle molecole
costituenti ed alle loro reciproche interazioni elettromagnetiche. Ci si deve
invece accontentare di caratterizzare uno stato fisico mediante la conoscenza
di pochi parametri macroscopici, direttamente misurabili da un osservatore
solidale col sistema, che rappresentano poi nella sostanza medie di quelle
caratteristiche microscopiche altrimenti inaccessibili: in un gas, ad esempio,
la pressione è legata alla quantità di moto delle molecole, come la temperatura
alla loro energia cinetica. Queste grandezze necessarie per fissare
informazioni sulla materia costituente il sistema si dicono variabili di
stato o coordinate termodinamiche, ed è
sufficiente che una di esse cambi per poter parlare di trasformazione.
Consideriamo ora una certa massa di gas che
venga in vario modo compressa passando comunque per gli stessi stati estremi
iniziale e finale, e rappresentiamone l'evoluzione in un diagramma pressione
volume come in fig.6.
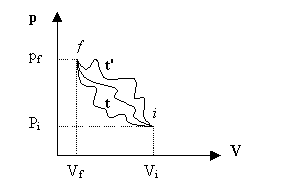
Fig.6 - Diagramma pressione/volume
Tutti i
cammini raffigurati sono ugualmente leciti, ma ciascuno di essi richiede che
venga eseguito sul sistema un diverso lavoro: immaginiamo di effettuare la
trasformazione in un pistone del tipo in fig.7.

Fig.7 - Gas in compressione
Nell'ipotesi
di una forza costante in modulo e con direzione sempre perpendicolare al
pistone possiamo applicare la (3):
![]() (10)
(10)
Esprimendo ora nella (10) la forza come
prodotto della pressione applicata per la superficie dello stantuffo, e la
variazione di altezza dello stesso come diminuzione di volume divisa per la
medesima area:
![]() (11)
(11)
Col la (11) si intuisce allora come il lavoro
eseguito lungo una qualsiasi trasformazione sia rappresentato dall'area sottesa
nel diagramma pressione volume.
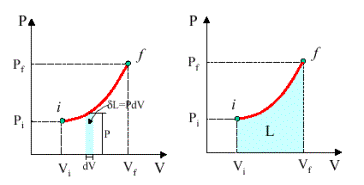
Fig.8 - Lavoro come area sottesa
Per
ciascuna della trasformazioni di fig.6, quindi, il sistema subisce un diverso
lavoro e cede un diverso calore: tuttavia, afferma il primo principio, la
quantità d'energia complessivamente scambiata con l'ambiente dev'essere la
stessa.
Consideriamo
infatti una trasformazione reversibile che porti il sistema da i
a f
lungo t
e di nuovo da f a i lungo t'. La variazione totale di
energia "nell'andata" deve essere uguale e contraria a quella
"nel ritorno", perché altrimenti, al termine del ciclo, risulterebbe
creata o distrutta energia in contrasto col primo principio. La variazione di energia nel sistema che passa da uno
stato all'altro, quindi, deve dipendere solamente dagli stati iniziali e
finali, non dalla via seguita.
Detto in
altra maniera, la somma di tutte la energie possedute da un sistema dipende
unicamente dallo stato nel quale il sistema si trova: questo è il significato
fisico del primo principio. A tale somma, inoltre, si dà il nome di energia
interna, ed essa costituisce, per quanto sopra, una funzione di
stato.
Formalmente
si può pensare ad essa come risultante dai contributi di energia cinetica
interna ed energia potenziale interna, legate rispettivamente alla temperatura
ed al volume del sistema (guarda caso altre due variabili di stato!), e
considerarla un indicatore dell'agitazione termica delle molecole.
Nella
maggior parte dei problemi di termodinamica, essendo l'osservatore solidale col
sistema, vengono trascurati gli eventuali scambi energetici che modifichino
moto o posizione di questo, ed assumono un ruolo preponderante quelli che al
contrario ne interessino l'energia interna, tanto che la versione più
utilizzata del primo principio della termodinamica è infine:
![]() (12)
(12)
Esercizi sul Primo Principio della Termodinamica
Premettiamo
che per le esercitazioni il nostro modello base di sistema sarà una sorta di
"scatolone adiabatico", ossia un contenitore rigido e termicamente
isolato, tale da essere indeformabile e da impedire gli scambi di calore con
l'ambiente.
Esercizio 1
Un
recipiente del tipo appena descritto contiene 100 l d'acqua alla temperatura
iniziale di 20 °C. Come in fig.1, un'elica mescolatrice azionata da un motore
da 0.5 CV di potenza agita il liquido per un tempo di 20 min.
Calcolare
la variazione di energia interna e di temperatura del fluido.
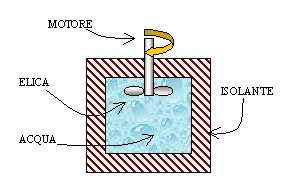
Fig.1 - Sistema del 1° esercizio
Soluzione
In primis
convertiamo i dati del problema in unità SI:
![]() (1)
(1)
![]() (2)
(2)
Osserviamo poi che, essendo nulla la cessione
di calore all'ambiente, in questo caso il primo principio della termodinamica
si riduce a:
![]() (3)
(3)
Il lavoro in questione è quello prodotto dal
motore, preso col segno meno in quanto subito dal sistema:
![]() (4)
(4)
Sostituendo nella (3) si ottiene subito la
variazione di energia interna richiesta:
![]() (5)
(5)
Per ricavare la corrispondente variazione di
temperatura è necessario conoscere la capacità termica specifica dell'acqua a
volume costante, definita dalla:
![]() (6)
(6)
Sapendo di avere 100 Kg di acqua, dalla (6)
si ha facilmente:
![]() (7)
(7)
Esercizio 2
Consideriamo ancora il sistema di partenza
dell'esercizio precedente; questa volta, tuttavia, i 100 kg di acqua sono
riscaldati per effetto Joule da una corrente di 6 A che passa per 5 min. su una
resistenza da 0.2 W.
Se volessi ottenere lo stesso aumento di
temperatura meccanicamente, con un sistema a puleggia come quello mostrato in
fig.2, quale caduta di quota dovrebbe subire la massa di 100 kg collegata
all'elica mescolatrice?
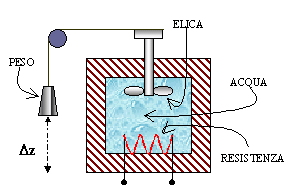
Fig.2 - Sistema del 2° esercizio
Soluzione
Convertiamo
subito i dati in unità del Sistema Internazionale dove necessario:
![]() (8)
(8)
Ancora partiamo dall'applicazione del primo
principio e osserviamo che trasferendo calore all'acqua mediante la resistenza
elettrica non viene compiuto lavoro sul sistema, mentre utilizzando l'agitatore
meccanico gli scambi propriamente termici sono nulli; ossia nelle due
trasformazioni, rispettivamente:
![]() (9)
(9)
![]() (10)
(10)
Ricordando la formula (11) della potenza
dissipata per effetto Joule, calcoliamo allora il calore ceduto dalla resistore
percorso da corrente:
![]() (11)
(11)
![]() (12)
(12)
Per la (9), esso si traduce completamente in
aumento dell'energia interna del sistema; se vogliamo ottenere lo stesso
effetto meccanicamente, per la (10) è necessario che l'elica esegua una pari
quantità di lavoro. Quest'ultimo è equivalente alla variazione di energia
potenziale della massa sulla carrucola secondo la legge:
![]() (13)
(13)
Dunque basta ricavare dalla (13) la
variazione di quota sufficiente per produrre attraverso la (10) quanto
garantito in altro modo dalla (12) e dalla (9):
![]() (14)
(14)
Chiaramente il risultato negativo indica che
il grave diminuisce la sua altitudine.
Esercizio 3
Un gas
perfetto subisce un'espansione che lo porta da uno stato A, caratterizzato da
una pressione di 32 bar ed un volume di 1 l, verso uno stato B, a 1 bar e 8 l.
Come
rappresentato sul diagramma di fig.3, esso può compiere tale variazione di
stato seguendo tre differenti "cammini":
a)
Trasformazione
isobara (a pressione costante), seguita da isocora (a volume costante);
b)
Trasformazione
in cui la pressione varia linearmente col volume;
c)
Trasformazione
adiabatica (senza scambio di calore), in cui la relazione tra pressione e
volume è del tipo
![]() (15)
(15)
Determinare per ognuno di questi
"percorsi" il lavoro compiuto dal sistema ed il calore scambiato con
l'ambiente.
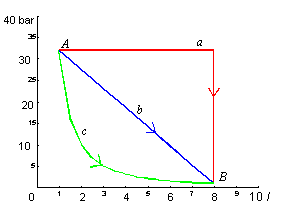
Fig.3 - Diagramma pressione / volume
Soluzione
Iniziamo
al solito normalizzando le unità di misura:
![]() (16)
(16)
![]() (17)
(17)
![]() (18)
(18)
![]() (19)
(19)
Osserviamo quindi che, essendo l'energia
interna una funzione di stato, poiché le tre trasformazioni hanno in comune gli
stati iniziale e finale, dovranno produrre la medesima variazione di tale
grandezza; ciò, tradotto in termini di primo principio della termodinamica,
significa:
![]() (20)
(20)
Il dato
notevole, infatti, è che l'adiabatica ha scambi termici nulli, dunque conviene
calcolare subito il lavoro eseguito dal fluido lungo di essa per ottenere
immediatamente il salto di energia interna comune a tutte le altre trasformazioni!
Sappiamo
che il lavoro è rappresentato dall'area sottesa nel diagramma pressione volume,
come in fig.4.
![]() (21)
(21)
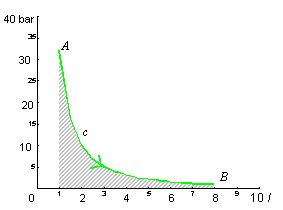
Fig.4 - Area sottesa dalla trasformazione c)
Tuttavia,
prima d'integrare dobbiamo ottenere dalla (15) l'espressione analitica della
curva c), per esempio imponendone il passaggio nel punto A:
![]() (22)
(22)
Ricavando la pressione in funzione del volume
dalla (22), allora:
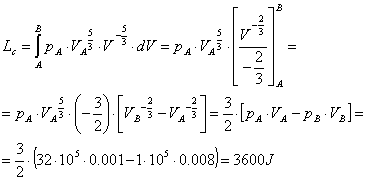 (23)
(23)
Col risultato ottenuto, non ci resta che calcolare analogamente il lavoro svolto lungo gli altri cammini per ottenere dalla (20) anche i rispettivi calori assorbiti.
Per la trasformazione a) in fig.5:
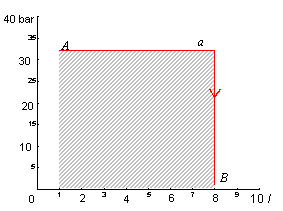
Fig.5 - Area sottesa dalla trasformazione a)
![]() (24)
(24)
E con la (20), ovvero il primo principio della termodinamica:
![]() (25)
(25)
Infine per la trasformazione c) in fig.6:

Fig.6 - Area sottesa dalla trasformazione c)
![]() (26)
(26)
Con l'assorbimento dall'ambiente di:
![]() (27)
(27)