PROPRIETA’ DELLE SOSTANZE PURE
Introduzione
In questa lezione si prenderanno in esame le proprietà delle sostanze pure. Ogni sostanza è caratterizzata da stati di aggregazione (detti anche fasi) dipendenti dalle condizioni termodinamiche, cioè dai valori di pressione, volume e temperatura della sostanza stessa. Le fasi sono caratterizzate da alcune proprietà:
|
· Fase solida |
È caratterizzata da forma e volume propri, infatti le forze intermolecolari sono talmente forti da determinare una struttura cristallina che ingabbia le molecole in posizioni ben determinate (es: cloruro di sodio). |
|
|
|
|
· Fase liquida |
È caratterizzata da volume proprio e forma variabile, infatti le forze intermolecolari hanno intensità minore rispetto alla fase solida; tale intensità non è sufficiente a conferire una forma propria alla sostanza che, perciò, assume la forma del recipiente in cui è contenuta (es: bicchiere d’acqua). |
|
|
|
|
· Fase aeriforme |
È caratterizzata da volume e forma variabili, infatti le forze intermolecolari sono talmente deboli (la minore intensità fra le tre fasi) da non poter vincere l’agitazione termica delle molecole; la sostanza tende ad occupare il maggior volume possibile, perciò la forma ed il volume sono imposte dal contenitore (es: bombola di metano). In genere si distinguono in gas e vapori a seconda delle condizioni termodinamiche. |
Per determinare le condizioni termodinamiche di una sostanza pura in un determinato stato di aggregazione, si fa riferimento al diagramma p-v-T (detto anche diagramma collinare) della sostanza (figura. 1).
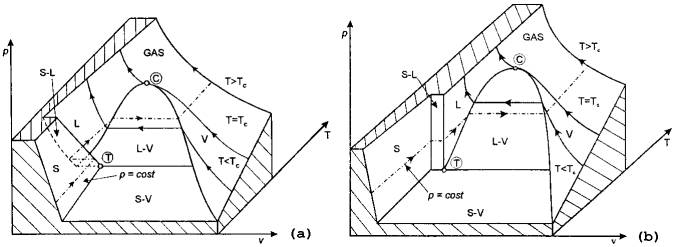
Figura 1: Diagramma collinare
per una sostanza che si comporta come l'acqua (a) o come gli idrocarburi (b).
Il diagramma
collinare è la rappresentazione tridimensionale della funzione ![]() , perciò rappresenta una superficie, non un volume. Nel
grafico sono indicate le lettere relative allo stato di aggregazione: Liquido,
Solido, Vapore e GAS.
, perciò rappresenta una superficie, non un volume. Nel
grafico sono indicate le lettere relative allo stato di aggregazione: Liquido,
Solido, Vapore e GAS.
Si può osservare che i due grafici collinari differiscono nel tratto della solidificazione (o fusione , dipendentemente dal senso della trasformazione). Le sostanze che, come l’acqua, aumentano di volume solidificando, hanno la regione S-L come quella del grafico (a); le sostanze che, come gli idrocarburi, diminuiscono di volume solidificando, hanno la regione S-L come nel grafico (b).
Si può osservare che, definite due coordinate termodinamiche, è sempre determinata la terza. Questa proprietà deriva immediatamente dalla regola delle fasi (o regola di Gibs):
![]() (1)
(1)
dove:
V è la varianza, il parametro che esprime il numero di coordinate indipendenti;
C è il numero di componenti (o sostanze);
F è il numero di fasi contemporaneamente presenti.
Questa regola è stata enunciata per sistemi aperti dove la massa è variabile, perciò C deve essere variabile; nel nostro caso, facendo riferimento a sistemi chiusi, dove la massa non varia, C è costantemente unitario, poiché nel sistema può esserci solo quella particolare sostanza studiata.
Applicata al
diagramma tridimensionale si può osservare che se è presente un unico stato di
aggregazione (![]() ) si ottiene
) si ottiene ![]() , cioè è possibile variare solo due coordinate termodinamiche
e la terza è univocamente determinata; se sono presenti due stati di
aggregazione contemporaneamente (
, cioè è possibile variare solo due coordinate termodinamiche
e la terza è univocamente determinata; se sono presenti due stati di
aggregazione contemporaneamente (![]() ) si ottiene
) si ottiene ![]() , cioè è possibile variare una unica coordinata e le altre
due sono univocamente determinate; se sono presenti tutti e tre gli stati (
, cioè è possibile variare una unica coordinata e le altre
due sono univocamente determinate; se sono presenti tutti e tre gli stati (![]() ) si ottiene
) si ottiene ![]() , cioè la condizione è determinata da una terna di valori ben
precisi.
, cioè la condizione è determinata da una terna di valori ben
precisi.
Da questo diagramma è possibile ricavare il diagramma p-v ed il diagramma p-T: è sufficiente intersecare il diagramma tridimensionale con dei piani “isotermici” e “isocori” rispettivamente.
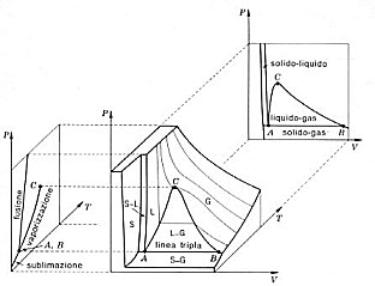
Figura 2: costruzione dei diagrammi p-v e p-T da quello collinare.
Da ognuno di questi è possibile trarre informazioni importanti sul comportamento della sostanza.
Diagramma p-v.
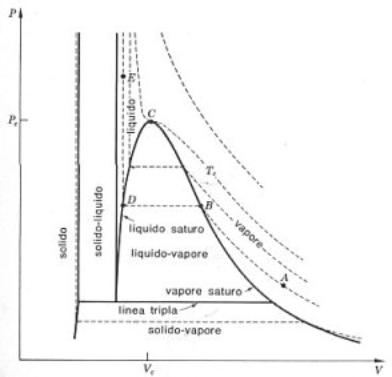
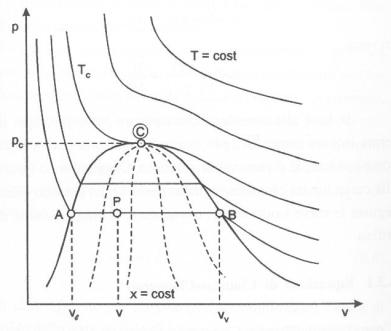
Figura 3: Diagramma p-v per una sostanza pura e curve isotitolo della miscela liquido-vapore.
Il diagramma p-v
rappresenta una famiglia di caratteristiche isotermiche, cioè ogni curva
rappresenta l’intersezione fra il diagramma collinare ed un piano a ![]() , perciò ogni linea rappresenta una trasformazione
isotermica.
, perciò ogni linea rappresenta una trasformazione
isotermica.
Se si introduce ![]() d’acqua a circa
d’acqua a circa ![]() in un recipiente di
circa
in un recipiente di
circa ![]() di volume in cui è
stato fatto preventivamente il vuoto, l’acqua evaporerà completamente e il
sistema si troverà nella condizione di vapore surriscaldato. Sul
diagramma p-v di fig. 3, questo stato è rappresentato, ad esempio, dal
punto A. Se ora il vapore viene compresso, a temperatura costante, la
pressione aumenterà fino a che, nel punto B, non si abbia vapore
saturo. Se si seguita a comprimere, il vapore condensa, mentre la
pressione, se non si varia la temperatura, rimane costante. Il segmento rettilineo BD rappresenta
la condensazione isobara ed isoterma di vapor d’acqua; il valore costante che
la pressione mantiene durante questo processo prende il nome di tensione di
vapore. In ogni punto del segmento BD c’è equilibrio fra acqua e
vapor d’acqua, mentre, nello stato rappresentato dal punto D si ha solo liquido
saturo. Poiché per comprimere l’acqua liquida serve un forte aumento di
pressione, la linea DE, che rappresenta gli stati del liquido
compresso, è pressoché verticale. In ogni punto della linea DE
l’acqua si trova nella fase liquida L; in ogni punto della linea AB
nella fase di vapore V; in ogni punto del segmento BD c’è equilibrio fra
fase liquida e fase di vapore L-V. La curva ABDE mostra l’andamento
tipico, in un diagramma p-v, delle isoterme di una sostanza pura.
di volume in cui è
stato fatto preventivamente il vuoto, l’acqua evaporerà completamente e il
sistema si troverà nella condizione di vapore surriscaldato. Sul
diagramma p-v di fig. 3, questo stato è rappresentato, ad esempio, dal
punto A. Se ora il vapore viene compresso, a temperatura costante, la
pressione aumenterà fino a che, nel punto B, non si abbia vapore
saturo. Se si seguita a comprimere, il vapore condensa, mentre la
pressione, se non si varia la temperatura, rimane costante. Il segmento rettilineo BD rappresenta
la condensazione isobara ed isoterma di vapor d’acqua; il valore costante che
la pressione mantiene durante questo processo prende il nome di tensione di
vapore. In ogni punto del segmento BD c’è equilibrio fra acqua e
vapor d’acqua, mentre, nello stato rappresentato dal punto D si ha solo liquido
saturo. Poiché per comprimere l’acqua liquida serve un forte aumento di
pressione, la linea DE, che rappresenta gli stati del liquido
compresso, è pressoché verticale. In ogni punto della linea DE
l’acqua si trova nella fase liquida L; in ogni punto della linea AB
nella fase di vapore V; in ogni punto del segmento BD c’è equilibrio fra
fase liquida e fase di vapore L-V. La curva ABDE mostra l’andamento
tipico, in un diagramma p-v, delle isoterme di una sostanza pura.
A temperature diverse, le
isoterme hanno andamenti simili, come mostrato dalle curve tratteggiate di fig.
3. Si noti che i segmenti che rappresentano gli stati in cui c’è equilibrio fra
liquido e vapore, le cosiddette linee di vaporizzazione, diventano
sempre più corte a mano a mano che la temperatura aumenta, fino a che non si
raggiunge la temperatura critica ![]() , al di sopra della quale non c’è più distinzione fra liquido
e vapore. L’isoterma alla temperatura critica si chiama isoterma critica
e il punto C, che costituisce il limite delle linee di vaporizzazione,
si chiama punto critico. Si nota che l’isoterma critica presenta nel
punto critico un flesso orizzontale. La pressione ed il volume corrispondenti
al punto critico si chiamano pressione critica
, al di sopra della quale non c’è più distinzione fra liquido
e vapore. L’isoterma alla temperatura critica si chiama isoterma critica
e il punto C, che costituisce il limite delle linee di vaporizzazione,
si chiama punto critico. Si nota che l’isoterma critica presenta nel
punto critico un flesso orizzontale. La pressione ed il volume corrispondenti
al punto critico si chiamano pressione critica ![]() e volume critico
e volume critico
![]() . Tutti i punti che rappresentano stati in cui si ha liquido
saturo, giacciono sulla cosiddetta curva di saturazione del liquido,
mentre i punti rappresentativi del vapore saturo, giacciono sulla cosiddetta curva
di saturazione del vapore. Queste due curve si incontrano nel punto
critico, al di sopra del quale le isoterme sono rappresentate da curve continue
che, per grandi valori del volume e piccoli valori della pressione,
approssimano le isoterme di un gas ideale.
. Tutti i punti che rappresentano stati in cui si ha liquido
saturo, giacciono sulla cosiddetta curva di saturazione del liquido,
mentre i punti rappresentativi del vapore saturo, giacciono sulla cosiddetta curva
di saturazione del vapore. Queste due curve si incontrano nel punto
critico, al di sopra del quale le isoterme sono rappresentate da curve continue
che, per grandi valori del volume e piccoli valori della pressione,
approssimano le isoterme di un gas ideale.
Nel diagramma di fig. 3 compaiono anche le zone di equilibrio S-L e S-V. Le isoterme che attraversano la zona S-V hanno lo stesso andamento di quelle a temperatura più alta. Il tratto di isoterma orizzontale rappresenta, in questo caso, la transizione del solido saturo al vapore saturo, cioè la sublimazione. Esisterà, evidentemente una curva che separa L-V dalla zona S-V. Tale linea è in relazione col punto triplo (T in fig. 1, A in fig. 2) ed è detta linea tripla.
La curva contenente la regione L-V è detta curva limite o curva di Andrews. Un parametro estremamente importante per queste miscele è il titolo (x) della miscela che è definito come:
![]() (2)
(2)
dove ![]() è la massa del vapore
e
è la massa del vapore
e ![]() è la massa del
liquido. Avendo a che fare con sistemi chiusi, in cui la massa totale della
sostanza non cambia, in ogni punto del segmento BD la quantità
è la massa del
liquido. Avendo a che fare con sistemi chiusi, in cui la massa totale della
sostanza non cambia, in ogni punto del segmento BD la quantità ![]() è la massa totale di
sostanza considerata; il titolo indica, perciò, la quantità di vapore riferita
al totale presente in ogni punto del segmento orizzontale. Una proprietà,
discendente direttamente da queste osservazioni, è la proprietà di tracciare
delle curve isotitolo che uniscono tutti i punti all’interno della curva limite
aventi il medesimo valore di titolo. Si può dimostrare che esiste una
proporzionalità fra la lunghezza del segmento ed il valore del titolo: se si
considera, ad esempio,
è la massa totale di
sostanza considerata; il titolo indica, perciò, la quantità di vapore riferita
al totale presente in ogni punto del segmento orizzontale. Una proprietà,
discendente direttamente da queste osservazioni, è la proprietà di tracciare
delle curve isotitolo che uniscono tutti i punti all’interno della curva limite
aventi il medesimo valore di titolo. Si può dimostrare che esiste una
proporzionalità fra la lunghezza del segmento ed il valore del titolo: se si
considera, ad esempio, ![]() , la curva isotitolo passerà per il punto mediano di tutti i
segmenti. Analogamente si può concludere che la curva del liquido saturo è la
curva isotitolo
, la curva isotitolo passerà per il punto mediano di tutti i
segmenti. Analogamente si può concludere che la curva del liquido saturo è la
curva isotitolo ![]() e che la curva del vapore saturo è la curva isotitolo
e che la curva del vapore saturo è la curva isotitolo ![]() .
.
Diagramma p-T
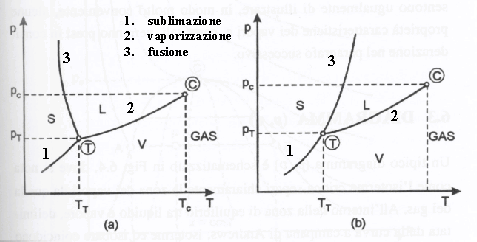
Figura 4: diagramma p-T per sostanze che si comportano come l’acqua (a) e per sostanze che si comportano come gli idrocarburi (b).
Il diagramma p-T
si ottiene da quello collinare intersecondo quest’ultimo con un piano del tipo ![]() . Il risultato è un grafico come quelli di fig. 4.
. Il risultato è un grafico come quelli di fig. 4.
Se si misura la tensione di vapore di un solido al variare della temperatura fino a che non si raggiunge il punto triplo, e poi quella del liquido fino a che non si raggiunge il punto critico, si ottiene un risultato che, riportato su un diagramma p-T, ha l’aspetto delle due curve più basse della figura 4. Il punto T è il punto triplo e C è il punto critico. Se si comprime la sostanza al punto triplo fino a che non c’è più vapore e poi si aumenta la pressione della miscela di liquido e solido, bisogna variare la temperatura se si vuole che liquido e solido restino in equilibrio. Si ottengono cioè, sperimentalmente, tre curve:
1. i punti che rappresentano stati in cui coesistono solido e vapore giacciono sulla curva di sublimazione;
2. i punti che rappresentano stati in cui coesistono liquido e vapore giacciono sulla curva di vaporizzazione;
3. i punti che rappresentano stati in cui coesistono liquido e solido giacciono sulla curva di fusione.
Nel caso particolare dell’acqua, la curva di sublimazione si chiama linea del gelo, quella di vaporizzazione linea del vapor d’acqua e quella di fusione linea del ghiaccio.
Qualunque sia la sostanza, le curve di vaporizzazione e sublimazione hanno pendenza positiva. La curva di fusione, invece, può avere pendenza positiva o negativa, anche se per la maggior parte delle sostanze la pendenza è positiva. Un’importante eccezione è costituita dall’acqua. Le sostanze che, come l’acqua, fondendo si contraggono, hanno una curva di fusione con pendenza negativa, mentre quelle che fondendo si dilatano, presentano curve di fusione con pendenza positiva. Il punto triplo è il punto di incontro delle curve di fusione, sublimazione e vaporizzazione. Solo in un diagramma p-T il punto triplo è effettivamente rappresentato da un punto; in un diagramma p-v esso è rappresentato da una linea. La tabella 1 raccoglie le coordinate dei punti triplo e critico di alcune sostanze.
Tabella 1: coordinate dei punti
triplo e critico di alcune sostanze.
|
Sostanza |
Punto triplo |
Punto critico |
||
|
PT [kPa] |
TT [K] |
PC [kPa] |
TC [K] |
|
|
CH4 |
11,72 |
90,68 |
4595 |
190,56 |
|
CO2 |
517 |
216,48 |
7377 |
304,20 |
|
H20 |
0,61 |
273,16 |
22055 |
647,13 |
|
N2 |
12,53 |
63,50 |
3390 |
126,20 |
|
NH3 |
6,10 |
195,49 |
11304 |
405,36 |
|
O2 |
0,15 |
54,36 |
5043 |
154,58 |
|
R134a |
0,39 |
169,85 |
4056 |
374,18 |
In un
diagramma p-T i punti che rappresentano stati di equilibrio di una sola fase
definiscono certe zone che sono limitate dalle varie curve di saturazione, cioè
dagli insiemi di punti che rappresentano stati di equilibrio di due fasi. Così,
nella figura 4, la zona del solido è limitata inferiormente dalla curva di
sublimazione e a destra dalla curva di fusione. Questa divisione in zone è in
certa misura arbitraria per le fasi limitate dalla curva di vaporizzazione, che
termina al punto C. Convenzionalmente si adottano come limiti della zona
del liquido la curva di fusione, la curva di vaporizzazione e l’isoterma
critica (rappresentata, in figura 4, dalla retta verticale tratteggiata). La
zona del vapore è limitata dalla curva di sublimazione, dalla curva di
vaporizzazione e dall’isoterma critica; questo significa che un vapore può
venire condensato diminuendo la temperatura o aumentando la pressione. La zona
del gas comprende, oltre alla zona del vapore, quegli stati per cui ![]() e
e ![]() . Un gas può venire sempre condensato diminuendo la
temperatura, ma non sempre aumentando la pressione. Per
. Un gas può venire sempre condensato diminuendo la
temperatura, ma non sempre aumentando la pressione. Per ![]() e
e ![]() non si può stabilire
una netta distinzione fra gas e liquido; perciò, generalmente questa zona è
detta zona del fluido.
non si può stabilire
una netta distinzione fra gas e liquido; perciò, generalmente questa zona è
detta zona del fluido.
Gas perfetti
I gas rappresentano le sostanze termometriche più convenienti, in virtù del fatto che il rapporto fra la pressione P del gas ad una certa temperatura e la pressione Pt dello stesso gas al punto triplo dell’acqua, tende a un valore costante indipendente dalla natura del gas al tendere di P e Pt a zero a volume costante
I gas vengono matematicamente modellati come:
· gas ideali;
· gas reali.
Il modello dei gas reali tiene conto del fatto che ogni gas è costituito da molecole aventi un determinato volume ed interagenti fra loro. Il volume delle molecole è da sottrarre al volume del sistema chiuso in cui è contenuto il gas; il fatto che tutte le molecole interagiscono fra loro, implica che esistano urti fra le molecole che vanno a modificare la pressione e la temperatura. Il modello dei gas ideali considera nullo il volume delle molecole e nulle le loro interazioni. Ovviamente nel mondo reale non esistono, a rigore, gas ideali, ma, in condizioni di bassissima pressione e grandissimo volume, è possibile considerare trascurabile il volume delle molecole rispetto a quello del sistema. E’ per questo che nei termometri a gas si utilizzano gas biatomici come l’ossigeno.
Nel diagramma collinare, quindi, i gas perfetti
stanno nella regione di p basse, v alte e ![]() . In questa regione si ottiene un diagramma p-v come in
figura 5.
. In questa regione si ottiene un diagramma p-v come in
figura 5.
Figura 5: diagramma p-v dei gas
perfetti.
L’equazione di stato, l’equazione che lega fra loro tutte le variabili termodinamiche, dei gas perfetti è:
![]() (2)
(2)
dove:
v è il volume specifico;
p è la pressione;
R è la costante dei gas perfetti;
T è la temperatura.
Questa la relazione in forma specifica. moltiplicando ambo i membri per la massa si ottiene la relazione in forma estensiva:
![]() (3)
(3)
Considerando la relazione:
![]() (4)
(4)
che lega il numero di moli della sostanza (n) alla massa (M) attraverso la massa molare (μ), si può riscrivere la (3), sostituendovi la relazione inversa della (4), ottenendo:
![]() (5)
(5)
Si pone, generalmente:
![]() (6)
(6)
Sostituendo la (6) nella (5) si ottiene:
![]() (7)
(7)
Considerando la relazione
![]() (8)
(8)
che lega il volume molare (![]() ) al volume della sostanza attraverso il numero di moli, si
può riscrivere la relazione (7) in questo modo:
) al volume della sostanza attraverso il numero di moli, si
può riscrivere la relazione (7) in questo modo:
![]() (9)
(9)
Le relazioni (2), (3), (7) e (9) sono equivalenti, perché sono la stessa equazione di stato dei gas perfetti espressa in modi diversi.
La massa molare (μ) è una costante dipendente solo dal gas e si può ricavare dalla tavola degli elementi. Due esempi sono:
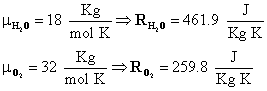
Si considerino ora i calori specifici. Essi sono definiti nel seguente modo:
![]() (10)
(10)
![]() (11)
(11)
Per i gas perfetti i calori specifici dipendono solo dalla temperatura, perciò le derivate parziali diventano derivate pure. Utilizzando il 1° principio della termodinamica applicato ad una trasformazione isobara ed una isocora ottengo:
![]() (12)
(12)
![]() (13)
(13)
e, sostituendo la (12) nella (10) e la (13) nella (11), si ottiene:
![]() (14)
(14)
![]() (15)
(15)
dalle quali si ottiene:
![]() (14)
(14)
![]() (15)
(15)
in cui si tiene conto del fatto che per ampi valori di temperatura il calore specifico è una costante.
Facendo le considerazioni analoghe per l’entropia si ottiene:
![]() (16)
(16)
Dal 1° principio applicato alle due trasformazioni si ottiene:
Trasformazione isobara:
![]() (17)
(17)
Trasformazione isocora:
![]() (18)
(18)
Sostituendo la (17) nella (16) e, successivamente, la (18) nella (16) ed utilizzando l’equazione di stato dei gas perfetti, si ottiene:
![]() (19)
(19)
![]() (20)
(20)
Prendendo un punto di riferimento a cui assegnare
le coordinate ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() , le (14), (15), (19) e (20) si possono riscrivere nel
seguente modo:
, le (14), (15), (19) e (20) si possono riscrivere nel
seguente modo:
![]() (21)
(21)
![]() (22)
(22)
![]() (23)
(23)
![]() (24)
(24)
Si può ora considerare una trasformazione isoentropica
in cui ![]() (non è altro che una
adiabatica reversibile). In questa condizione, facendo il rapporto membro a
membro delle (23) e (24), si ottiene:
(non è altro che una
adiabatica reversibile). In questa condizione, facendo il rapporto membro a
membro delle (23) e (24), si ottiene:
![]() (25)
(25)
Generalmente si indica:
![]() (26)
(26)
perciò l’equazione (25) si scrive:
![]() (27)
(27)
Si può dimostrare, utilizzando le (23) e (24) che:
![]() (28)
(28)
Le caratteristiche generali delle capacità termiche per i gas ideali sono molto semplici:
1. tutti i gas:
·
![]() è funzione solo di T;
è funzione solo di T;
·
![]() è funzione solo di T
ed è maggiore di
è funzione solo di T
ed è maggiore di ![]() ;
;
·
![]() ;
;
·
![]() è funzione solo di T
ed è maggiore di 1.
è funzione solo di T
ed è maggiore di 1.
2. gas monoatomici come He, Ne, Ar e la maggior parte dei vapori metallici, come quelli di Na, Cd, Hg:
·
![]() è costante su un
ampio intervallo di T ed è molto prossimo a
è costante su un
ampio intervallo di T ed è molto prossimo a ![]() ;
;
·
![]() è costante su un
ampio intervallo di T ed è molto prossimo a
è costante su un
ampio intervallo di T ed è molto prossimo a ![]() ;
;
·
![]() è costante su un
ampio intervallo di T ed è molto prossimo a
è costante su un
ampio intervallo di T ed è molto prossimo a ![]() .
.
3. gas biatomici cosiddetti permanenti, cioè H2, O2, N2:
·
A T ordinarie ![]() e
e ![]() sono pressoché
costanti, mentre a temperature più alte crescono lentamente;
sono pressoché
costanti, mentre a temperature più alte crescono lentamente;
·
A T ordinarie ![]() è pressoché costante,
mentre a temperature più alte decresce lentamente.
è pressoché costante,
mentre a temperature più alte decresce lentamente.
Si può notare che, sebbene ![]() e
e ![]() dipendano dalla
sostanza, il loro rapporto tenda ad un valore costante che per gas biatomici è
dipendano dalla
sostanza, il loro rapporto tenda ad un valore costante che per gas biatomici è ![]() . Tanto più μ tende ad 1 tanto più la trasformazione
assume carattere reversibile, perciò, dall’equazione (27), si ottiene una
isoterma se la trasformazione è perfettamente reversibile.
. Tanto più μ tende ad 1 tanto più la trasformazione
assume carattere reversibile, perciò, dall’equazione (27), si ottiene una
isoterma se la trasformazione è perfettamente reversibile.